据药融云数据检测,2023年3月9日,安斯泰来制药公司(TSE:4503)和Seagen公司(纳斯达克:SGEN)宣布,中国NMPA/CDE(国家药品监督管理局药品审评中心)已接受enfortumab vedotin的生物制剂上市许可申请(BLA)(一款潜力ADC,针对Nectin-4),用于治疗先前接受PD-1/L1抑制剂和铂类化疗的局部晚期或转移性尿路上皮癌(la/mUC)患者。
截图来源:药融云中国药品审评数据库
安斯泰来公司高级副总裁兼开发治疗领域负责人Ahsan Arozullah说:“2020年中国有近86,000个膀胱癌新病例,我们正在与中国NMPA合作,寻求批准enfortumab vedotin用于晚期疾病患者。”“Enfortumab vedotin已经成为世界各地许多先前接受过治疗的局部晚期或转移性尿路上皮癌患者的二线和三线治疗选择,在中国获得批准可能会给这些患者带来这种治疗。”

此外值得一提的是:就在4月3日,Seagen与安斯泰来公司宣布美国FDA加速批准Keytruda(PD-1)+enfortumab vedotin联合一线治疗局部复发性或转移性尿路上皮癌。

安斯泰来制药(Astellas Pharma Inc. TYO: 4503),全称安斯泰来制药集团,成立于2005年,总部位于日本东京,是一家以从事研发型制药为主的公司。该公司已经在器官移植领域和泌尿领域成为全球专业药物治疗领域领导者。借助独特的产品线,安斯泰来逐步在其他目标领域培养支柱产品,在抗肿瘤领域,安斯泰来拥有了先进的抗体药物研究技术(《安斯泰来的过去及现在与未来|亚洲第二大药企》)。
据药融云数据www.pharnexcloud.com/?zmt-mhwz显示:截止2023年3月,安斯泰来制药集团全球员工15,000人,集团在全球范围内研发、生产及销售创新型医药产品,业务遍及全球70多个国家和地区。安斯泰来于1994年进入中国,在中国市场销售的产品涉及肿瘤、移植免疫、泌尿等等多个专业治疗药物领域。
一、源于两大药企联合,被赋予高起点

药融云数据显示:安斯泰来由山之内制药株式会社与藤泽制药株式会社合并而成,这两家制药企业都有着悠久的发展历史。山之内制药成立于1923年,而藤泽制药的历史更是可以追溯到1894年。
对于日本制药企业来说,政府的保护和自己的保守曾经让它们在本土市场尝到了“甜头”。但是同时保守带来的弊端也开始逐步显现。日本从上世纪80年代开始向经济开放方向迈进,特别是医药行业打破之前的规制,日本市场开始向欧美医药企业开放。为了防止被收购,最重要的就是要提高医药企业价值,于是如何才能提高企业价值成为关键。
彼时两大日本制药公司藤泽和山之内都有将企业做成国际性研发型制药企业的愿景。同时这两家公司在诸多业务领域又有很多互补之处。在日本,它们的并购被企业界视为加速全球化的标杆。
事实上,之前两家公司在诸多业务领域有很强的互补性。销售区域方面,山之内的优势是在日本、欧洲和亚洲,而藤泽公司则在美国和日本占据优势,两者合并后便形成了全球业务版图;新产品研发方面,山之内长于化学合成领域,藤泽的优势则在发酵方面;山之内的业务优势在泌尿领域,藤泽是在器官免疫领域。合并后的安斯泰来放弃了健康保健用药市场,聚焦利润更高的处方药市场,并且公司有核心技术可以在处方药上大做文章。
除了专业领域方面的调整,安斯泰来在组织融合方面也下了功夫。在公司合并工作中最大的难题,就是使两家公司完全融合成为一个整体。安斯泰来一改随波逐流的做法,并没有将两家公司名称合并在一起,而是起了一个全新的名字——Astellas,该词源于拉丁语单词“stella”,寓意是闪闪发亮的星星,还与日语短语“让明天闪耀”相关联。Astellas的愿景是“在医疗保健行业变革的前沿,将生物技术创新科学转化为对患者的价值”。

Naoki Okamura 总裁兼CEO(于2023年4月1日正式上任)
2023年2月5日,安斯泰来宣布现任执行副总裁兼首席战略官Naoki Okamura(冈村直树)被任命为公司新总裁兼CEO,继续推进2021-2025财年战略计划,以推动业绩进一步增长。现任总裁兼CEOKenji Yasukawa(安川健司)被任命为公司董事会主席。
二、新药小插曲:重磅药物fezolinetant审期被延长
2023年2月20日,安斯泰来制药公司宣布,公司于2月17日收到美国FDA通知,FDA将延长公司旗下更年期药物fezolinetant的PDUFA日期至2023年5月22日。去年,安斯泰来申请批准时使用了优先审评券,获得了优先审查资格,将审查时间缩短了4个月,原定FDA对fezolinetant的决定日期为2月22日。
安斯泰来使用优先审查资格主要有两方面原因。第一是安斯泰来对该候选药物寄予厚望。公司已经确定,到2025年,几个核心资产将总计带来89亿美元的销售额,而fezolinetant作为潜在销售额可达15亿美元的重磅炸弹药物正是其中的重要组成。
第二是竞争对手拜耳的疗法在身后步步紧逼。2020年,拜耳以4.25亿美元收购KaNDy Therapeutics加入了VMS的竞争。2021年,KaNDy Therapeutics的候选药物elinzanetant开始了三个后期临床试验。拜耳预计三项研究的完成日期约为今年3月至7月。如今,FDA未能在最后期限前完成对安斯泰来提交审查,已扰乱了其快速获批的计划。
Fezolinetant是由安斯泰来于2017年以5亿欧元(5.34亿美元)首付款收购Ogeda所获得的。Fezolinetant是一种潜在first-in-class口服非激素类的选择性神经激肽3 (NK3)受体拮抗剂,用于治疗绝经相关中重度VMS,通过阻断神经激肽B(NKB)与Kisspeptin/神经激肽/强啡肽(KNDy)神经元的结合,调节脑(下丘脑)体温调节中枢的神经元活动,以降低绝经相关中重度VMS的发生频率和严重程度。相关专利:WO-2011121137、WO-2014154895。
Fezolinetant药物研发信息(部分,完整内容请登陆“药融云数据库www.pharnexcloud.com/?zmt-mhwz”查看)

截图来源:药融云数据全球药物研发数据库
VMS是更年期最常见且最令人烦恼的症状,主要表现为潮热和/或盗汗,50%以上40至64岁的女性受到影响,症状中位持续时间可达7.4年。目前激素疗法虽然有效,但对于心脑血管疾病和某些恶性肿瘤风险较高的女性来说,出于安全考虑,也亟需一款非激素疗法。而其它替代疗法方面,可选择的药物种类有限且具有一定的使用禁忌。因此,以fezolinetant为代表的NK3受体拮抗剂被认为在治疗VMS方面拥有良好的前景。
公司高级副总裁兼开发治疗领域负责人Ahsan Arozullah说道:“公司仍然对fezolinetant的临床状况以及可能给更年期经历中度至重度血管舒张症状的妇女带来的潜在获益充满信心。安斯泰来将继续与FDA合作,配合完成fezolinetant的NDA审查。”
三、基因替代疗法AT845取得积极进展
安斯泰来正在开发新的基因替代疗法AT845,即在肌肉特异性启动子下使用AAV8载体,传递GAA基因的功能性拷贝,用于治疗成人晚发型庞贝氏症。功能性GAA基因经有效转导,可直接在受疾病影响的组织(包括骨骼肌和心肌)中表达GAA,基因替代疗法AT845正在研究中,以确定该疗法是否能传递GAA基因。
据药融云全球医药交易数据库显示,AT845最早由Selecta Biosciences Inc开发,2023年1月9日,授予安斯泰来该药的开发和商业化许可,首付金额1000万美元,预计总支付金额3.5亿美元。
截图来源:药融云全球医药交易数据库
2023年2月24日,安斯泰来制药集团宣布了正在进行的FORTIS I/II期临床试验的最新初步安全性和疗效数据,该试验旨在评估研究性AT845治疗晚发型庞贝氏症(LOPD)成人患者的安全性、耐受性和探索性疗效。这些数据将在佛罗里达州奥兰多举行的第19届年度世界研讨会上进行展示。AT845是一种研究性腺相关病毒(AAV)基因替代疗法,旨在将功能性人类α-葡萄糖苷酶(GAA)基因直接传递到LOPD成人患者的肌肉细胞中。

英国纽卡斯尔大学纽卡斯尔医院NHS基金会信托基金的神经肌肉疾病教授和荣誉临床遗传学家Jordi Díaz-Manera博士表示:"LOPD这样的进展性、衰竭性、遗传疾病亟需超越标准治疗的酶替代疗法(ERT)的新疗法。"AAV基因疗法有可能成为一种安全且有效的疗法,直接向LOPD患者的肌肉组织传递功能性GAA基因。
FORTIS是一项正在进行中的多中心、开放标签、剂量递增的I/II期的首次人体临床试验,旨在确定AT845对LOPD成人患者的安全性、耐受性和探索性疗效。截至2022年9月15日的数据截止日,有四名受试者接受了一次性静脉注射AT845,其中两名以3x1013vg/kg的剂量标准给药,两名以6x1013vg/kg的剂量标准给药,该临床试验的安全随访期长达78周。四名受试者中的三人在服用AT845后不再继续接受ERT治疗。这三名受试者在停止ERT治疗后的19周、44周和51周经测量的功能结局一直很稳定。对用药受试者(包括那些不再继续接受ERT治疗的患者)的持续评估显示,疾病功能终点持续稳定,包括用力肺活量和六分钟步行测试。患者报告的疲劳和日常活动(庞贝特异性)结果也显示稳定。

各受试者对AT845的输注普遍耐受性良好,大多数治疗期间不良反应都很轻微(1级),且被认为与研究性治疗无关。一名受试者发生了可能的输液相关反应,在口服苯海拉明和对乙酰氨基酚后消退。三名受试者发生了短暂的转氨酶升高,被认为可能与AT845有关。在所有病例中,该事件在对免疫抑制进行剂量调整后恢复。6x1013 vg/kg队列中的一名受试者被报告发生了2级周围感觉神经病变事件,这导致FDA在2022年6月发出了临床试验暂停通知。FDA于2023年1月解除了这一临床试验暂停禁令。道阻且长,值得投入的基因治疗领域。
“我们很高兴分享正在进行的AT845 FORTIS临床研究的新发现。这些数据,加上我们近期宣布的FORTIS临床试验暂停禁令已解除,表明该项目取得了非常积极的进展,”安斯泰来公司执行医疗总监Ha Tran表示“初步数据令人备受鼓舞。我们正朝着开发创新基因疗法并为需求高度未获满足的患者带去新的潜在疗法的目标前进,期待继续推进FORTIS临床试验各项工作。”
庞贝氏症是一种严重且罕见的常染色体隐性代谢疾病,会引起进行性肌肉退化。在新生儿中的总发病率约为1/40000,1但发生率和疾病进展因患者的发病年龄、种族和所在地区而异。2庞贝氏症由GAA基因突变引起,此种突变妨碍了酸性α-葡萄糖苷酶(GAA)的产生和正常功能的发挥。GAA负责代谢糖原,缺乏这种蛋白质或其功能失调,会导致糖原在组织中聚积,主要集中在骨骼肌和心肌内,导致组织结构和功能损伤。目前获批用于庞贝氏症治疗的只有酶替代疗法(ERT),这种疗法是一种长期治疗,每两周进行一次静脉输注,完全依靠组织从血浆中吸收GAA。
四、业绩状况
01.2022财年三季度报告(2022.4.1-2022.12.31)

2023年2月6日,安斯泰来公布2022财年前三季度全球财务业绩。2022财年前九个月营收1.16万亿日元(约106亿美元),同比增长17.3%,核心营业利润为2337亿日元(约21.4亿美元)。
销售和一般管理费用同比增长15.9%至4710亿日元(约43亿美元)。不包括在美国的XTANDI(恩扎卢胺,enzalutamide)共同推广费用在内,销售和一般管理费用同比增长11.8%至3327亿日元(约30.4亿美元)。
研究和开发费用同比增长16.0%至2061亿日元(约18.8亿美元),除了汇率影响(同比增加230亿日元,约2.1亿美元)外,总金额增加是因为在2022财年第一季度使用fezolinetant优先审凭券相关费用(138亿日元,约1.3亿美元)。研发成本收入比率同比下降0.2个百分点至17.7%。
核心产品业绩

安斯泰来全球增长由以下核心产品推动:前列腺癌药物XTANDI(恩扎卢胺,enzalutamide)、急性髓系白血病治疗药物XOSPATA(gilteritinib,吉列替尼)、转移性尿路上皮癌ADC药物PADCEV(enfortumab vedotin-ejfv)和肾性贫血治疗药物Evrenzo(roxadustat,罗沙司他)。


2022财年前三季度,XTANDI(恩扎卢胺,enzalutamide)销售额同比增长24.4%,达到5119亿日元(约46.8亿美元);PADCEV(enfortumab vedotin-ejfv)销售额同比增长126.9%,达到331亿日元(约3.0亿美元);XOSPATA(吉列替尼,gilteritinib,)销售额同比增长41.1%,达到363亿日元(约3.3亿美元);EVRENZO(罗沙司他,roxadustat)销售额同比增长15.0%,达到24亿日元(约2192.9万美元);Betanis /Myrbetriq /BETMIGA(米拉贝隆,Mirabegron)销售额同比增长11.1%,达到1410亿日元(约12.9亿美元);Prograf(他克莫司,Tacrolimus)销售额同比增长7.5%,达到1516亿日元(约13.9亿美元)。

安斯泰来有五大市场区域:日本、美国、成熟市场、大中华区以及国际市场。从2022财年第三季度开始,安斯泰来将澳大利亚的商业部门从成熟市场移除,划进国际市场。(注:成熟市场包括欧洲、加拿大、澳大利亚;大中华区包括中国的大陆地区、香港地区和台湾地区;国际市场包括俄罗斯、拉美、中东、非洲、东南亚、南亚、韩国、出口销售额等。)
从地域上看,与2021年前三季度一样,在2022年前三季度中,美国仍然是安斯泰来主要营收来源市场,其营收总额为5011亿日元(约45.8亿美元),营收额是本土日本市场的近2.5倍,同比增长22.8%;其次是包含欧洲和加拿大地区的成熟市场,营收总额为2711亿日元(约24.8亿美元),同比增长16.4%。另外,同比增速最快的是大中华区市场,同比增长29.4%。
02.2021财年年度报告(2021.4.01-2022.3.31)
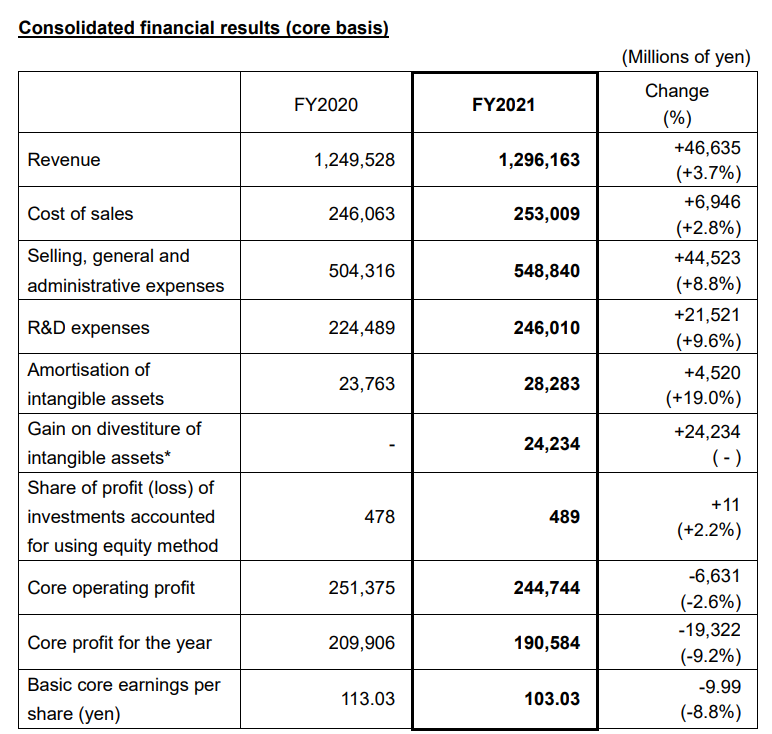
2022年4月27日,安斯泰来公布2021财年业绩数据。2021财年,安斯泰来实现营收1.30万亿日元(约118.8亿美元),同比增长3.7%;销售和一般管理费用同比增长8.8%至5488亿日元(约50.1亿美元);核心营业利润为2447亿日元(约22.4亿美元);研究和开发费用增长9.6%至2460.1亿日元(约22.5亿美元)。


2021财年,XTANDI营收额为5343亿日元(约48.8亿美元),同比增长16.6%。XTANDI销售额在所有地区均有所增长,这是由于致力于进一步加强市场准入,进一步提高了XTANDI在泌尿科领域的渗透率,以及积累的临床试验的稳健数据扩大了早期前列腺癌的处方。与2020财年相比,该产品在美国的销售额大幅增长,在欧洲,转移性激素敏感性前列腺癌(M1HSPC)的额外适应症(于2021年4月批准)促进了销售额的增长。此外,在日本中国和国际市场的销售额继续呈现强劲增长。
Xospata营业额为341亿日元(约3.1亿美元),同比增长42.9%。主要是由于Xospata在血液学/肿瘤学领域中的渗透,使得该产品在所有销售地区的销售都有所扩大,并通过提高产品知名度和对FMS样酪氨酸激酶3(FLT3)突变的检测率,确立了其作为市场领导者的地位。相较于2020财年,该产品除了在美国和欧洲的销售额有所增长外,在中国的销售额也有所增长(该产品于2021年4月在中国上市)。此外,在国际市场上批准Xospata的国家数量有所增加,在日本,Xospata凭借其目前的适应症获得了很高的市场份额。
PADCEV营业额为217亿日元(约1.98亿美元),同比增长69.5%。在美国,合作促进的收入如预期的增长,这是由于确立了其作为现有适应症患者首选治疗方案的地位,以及额外的指示“不符合资格接受含顺铂化疗的当地晚期或转移性尿路上皮癌患者,并且以前曾接受过一个或多个先前的治疗项目“(2021年7月批)。在日本,该产品于2021年11月推出,市场吸纳率高于预期。此外,在2022年4月,PADCEV在欧洲获得批准,用于治疗先前接受含铂化疗和PD-1或PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者。
EVRENZO营业额为26亿日元(约2375.6万美元),同比增长131.5%。虽然日本的销售额扩大主要是由于主动扩大市场份额,但由于市场竞争激烈,销售额低于预期在欧洲,EVRENZO于2021年9月月推出,销售额低于预期,原因是推出时的销售推广活动受到COVID-19蔓延的影响,以及其与现有标准治疗的差异化渗透率低于预期。
Betanis / Myrbetriq / BETMIGA营业额为1723亿日元(约15.7亿美元),同比增长5.3%。销售额在全球范围内扩大,主要是在欧洲和日本。
Prograf营业额为1854亿日元(约16.9亿美元),同比增长1.5%。全球销售额与预期相符,但存在地区差异。在欧洲和中国的销售增长,而在美国和日本的销售下降。
五、研发管线
安斯泰来在器官移植和泌尿领域拥有全球最领先的治疗药物和技术,并不断加强在抗肿瘤、神经科学和基因治疗等领域的研发投入。2021财年安斯泰来研发投入2460.1亿日元(约22.5亿美元)。安斯泰来的管线覆盖移植、免疫学、传染病、泌尿科、肿瘤学、神经科学、糖尿病并发症和代谢性疾病等多个治疗领域。(以下该公司的产品研发管线更新日期截至2023年2月6日)
01.XTANDI和战略产品

02.重点领域类项目

03.其他

04.Rx+®计划

注:本文货币兑换以2023年3月13日的汇率为准:1日元=0.0091美元,1美元≈109.4451日元,有图表数据参考的除外。
参考:
NMPA/CDE;
药融云数据,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官方);
https://www.astellas.com/en;
https://www.astellas.com/en/news/27281;
https://www.prnewswire.com/news-releases/astellas-announces-update-on-preliminary-safety-and-efficacy-data-from-fortis-study-of-investigational-at845-in-adults-with-late-onset-pompe-disease-301750884.html;
石丹《安斯泰来-以并购抵御被并购的威胁》(BMR商学院);
https://baike.baidu.com/item/%E5%AE%89%E6%96%AF%E6%B3%B0%E6%9D%A5%E5%88%B6%E8%8D%AF/12742485?fr=aladdin;
https://finance.sina.com.cn/stock/med/2023-02-21/doc-imyhniys8672151.shtml;
https://view.inews.qq.com/a/20201018A0B4HN00;
https://finance.sina.cn/stock/med/2023-02-21/detailimyhniys8672151.d.html?br/a%20href=/*;
等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论