
摘 要
常规C18色谱柱的pH耐受范围为2-8,强酸性化合物的pKa一般小于2,强碱性化合物的pKa一般大于9,很难在常规C18上实现保留。抛开石墨碳色谱柱(pH耐受范围0~14)、HILIC色谱柱、离子交换色谱柱不谈,若要在常规C18上实现有效保留,对于强酸性化合物,可通过离子对色谱法实现保留;对于强碱性化合物,可通过离子对色谱法或离液剂实现保留。本文的目的旨在通过对两者的保留机理进行浅析、并结合一些案例来阐明二者保留机理的异同。
图1为RP-HPLC中离子对试剂的作用机理。首先,在流动相中添加一定量的两亲烷烃离子对试剂。若分析物为强碱性化合物(pKa一般大于9),通常会在流动相中添加烷基磺酸盐离子对试剂,如己烷磺酸钠、庚烷磺酸钠、辛烷磺酸钠等;若分析物为强酸性化合物(pKa一般小于2),通常流动相中会添加四烷基铵盐或烷烃铵盐离子对试剂,如四丁基溴化铵、四丁基碘化铵、四丁基氢氧化铵、己胺、辛胺等。而后,C18长链被流动相浸润,经过长时间的柱平衡,流动相中离子对试剂的疏水(亲脂)端,即烷基部分,与C18长链强力吸引;离子(亲水)端,即磺酸阴离子或氮正离子则暴露于固定相与流动相的相界面上。当被分析离子化合物进入色谱柱时,强碱性化合物/强酸性化合物与相界面上的磺酸阴离子/氮正离子产生静电作用,从而产生保留。
考虑到烷烃磺酸pKa约为1,强碱性化合物pKa约为9,为保证烷烃磺酸与强碱化合物均完全离子化,流动相的pKa应偏离二者的pKa至少2个单位,故在用离子对色谱法分析强碱性化合物时,流动相的pH应在3~7的范围。考虑到四烷基铵盐或烷烃铵盐pKa约为10,强酸性化合物pKa约为2,同理可得,当在用离子对色谱法分析强酸性化合物时,流动相的pH应在4~8的范围。如若要同时兼顾流动相的缓冲能力,可选的缓冲盐有磷酸盐(pKa3.2&7.2)、甲酸盐(pKa3.8)、乙酸盐(pKa4.7)。如若要在同一个分析方法中同时实现强酸与强碱化合物的保留时,可在流动相中同时添加烷基磺酸盐离子对试剂以及四烷基铵盐或烷烃铵盐离子对试剂,同时维持流动相的pH在4~7即可。
需指出,离子对试剂中亲脂的疏水端与C18长链的“吸附”往往是不可逆的,也就是说离子对试剂对色谱柱的改性难以避免的。“专柱专用”是避免离子对色谱法难以重现的有效办法。

图1 离子对试剂增加质子化碱性化合物保留因子的机理
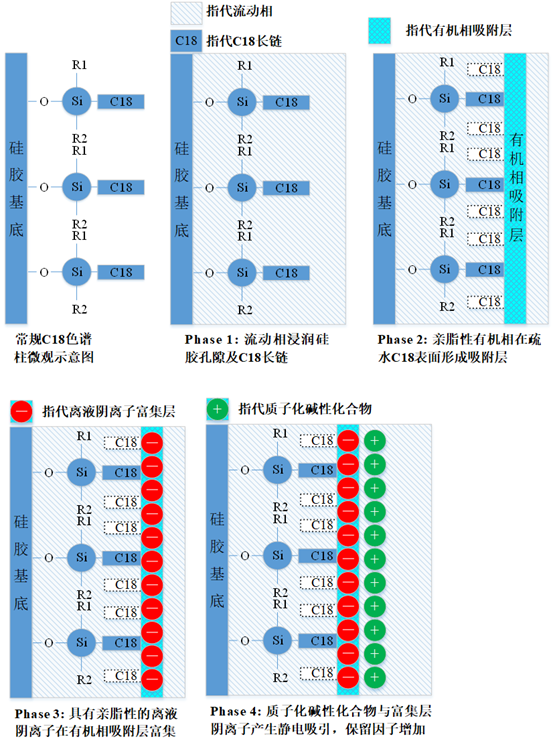
图2 离液阴离子增加质子化碱性化合物保留因子可能的机理
在开始阐述离液试剂的可能作用机理之前,需指明我们平常说的离液试剂一般为亲脂性的无机阴离子,其仅对碱性化合物的保留有增益。根据范特霍夫(Franz Hofmeister)理论[1],离液型离子(英文名为Breaker/Chaotrope)有氯离子、硝酸根离子、三氟乙酸跟离子、四氟硼酸根离子、高氯酸根离子、六氟磷酸根离子等。上述离子离液序列依次为:氯离子<硝酸根离子<三氟乙酸跟离子<四氟硼酸根离子<高氯酸根离子<六氟磷酸根离子。随着范特霍夫离液序列的增加,等当量的离液阴离子扰乱流动相中水-水、水-甲醇或水-四平呋喃之间氢键的能力增加,破坏碱性质子化分析物的溶剂化分子层的能力增强。
图2为RP-HPLC中离液试剂的可能作用机理。使用离液剂进行碱性质子化合物分析时,首先在流动相中添加一定浓度的离液盐试剂,常用的有三氟乙酸跟离子、四氟硼酸根离子、高氯酸根离子以及六氟磷酸根离子。随着色谱柱的平衡,疏水C18表面会富集形成亲脂的有机相层(如甲醇、乙腈、四氢呋喃)。随后亲脂的离液阴离子会在有几层相界面富集,形成具有阳离子交换性质的“伪固定相”层。当被分析的碱性质子化合物进入色谱柱时,离液阴离子会破坏分析物的溶剂化分子层,通过静电作用,形成“碱质子化合物-离液阴离子”中性化合物。从而产生或增强保留。
下面,将结合几个案例来进行说明。
尝试用不同摩尔浓度的六氟磷酸根进行盐酸多佐胺的分析时[2],发现随着六氟磷酸根浓度的增加行盐酸多佐胺的保留时间显著增加,且盐酸多佐胺的对称性及理论板数也同步增加,如图3所示。
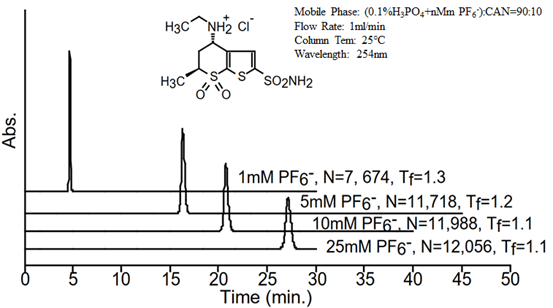
图3 不同浓度六氟磷酸根对盐酸多佐胺保留、对称性及理论板数的影响
尝试用含50mM六氟磷酸根的酸性流动相,对6种碱性毒性生物胺进行反相分离[3],六种质子化毒性生物胺均得到了有效保留,且实现了良好的RP-HPLC分离,如图4所示。
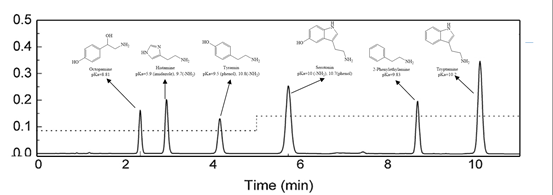
图4 含50mM六氟磷酸根的酸性流动相体系下,6种毒性生物胺的保留及分离情况
以上,笔者根据相关文献及个人见解,分析了离子对试剂与离液剂试剂在作为添加剂时对化合物保留的机制。根据相关案例,可以得出相较与离子对试剂,离液剂的添加不会造成色谱柱的改性。随着离液剂浓度的增加,目标碱性质子化合物的保留随之增加,但需指出当离液剂达到一个临界浓度时,对于保留因子k不会再有增益。此外,离液剂可以让极弱疏水性碱性质子化合物在常规C18上产生保留,如案例2所示(Histamine: LogD(pH5.5) = -4.20,2-Phenylethylamine: LogD(pH5.5) = -1.52, Tyramine: LogD(pH5.5)=-2.5, Octopamine: LogD(pH5.5) = -3.45, Tryptamine: ACD/LogD(pH5.5) = -1.42,Serotonin: LogD(pH5.5) = -2.49)。个人看法,若有纰漏之处,望同行指正。
相关阅读:
《HPLC方法开发需注意的典型特殊结构化合物专题:酮式烯醇式互变》
参考文献
[1] Cecchi T, Passamonti P. Retention mechanism for ion-pair chromatography with chaotropic reagents. J Chromatogr A 2009; 1216:1789-97
[2] Li Pana, Rosario LoBruttoa. ThompsonInfluence of inorganic mobile phase additives on the retention, efficiency and peak symmetry of protonated basic compounds in reversed-phase liquid chromatography. Journal of Chromatography A, 1049 (2004) 63–73
[3] JianJun Zhong, Ningbo Liao. Liquid chromatographic method for toxic biogenic amines in foods using a chaotropic salt. Journal of Chromatography A, 1406 (2015) 331–336。
<END>






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论