
引言
当地时间2022年6月13日,美国食品和药物管理局(FDA)批准了礼来JAK抑制剂baricitinib(Olumiant/巴瑞替尼)口服片剂用于治疗患有严重斑秃的成年患者,该疾病每年在美国影响超过300,000 人。巴瑞替尼此前还获得了针对严重斑秃的优先审查和突破性疗法认定,此次获批是FDA首次批准斑秃的全身疗法(即治疗全身而非特定部位)。
“获得安全有效的治疗方案对于大量受严重脱发影响的美国人至关重要,”FDA药物评估和研究中心皮肤病学和牙科部主任Kendall Marcus医学博士说。 “今天的批准将有助于满足严重斑秃患者的重大未满足需求。”
关于斑秃
斑秃,俗称脱发,是一种自身免疫性疾病,患者的免疫系统会攻击自身的毛囊,导致头发脱落,且通常成团。
关于巴瑞替尼
巴瑞替尼基本信息

截图来源:药融云全球药物研发数据库(新版)
巴瑞替尼是一种Janus激酶 (JAK) 抑制剂,可阻断一种或多种JAK激酶家族成员的活性,从而抑制激活炎症的途径。这款口服JAK抑制剂由礼来公司和Incyte合作开发。
经药融云数据库查询,巴瑞替尼最早于2017年在欧盟和英国上市,获批适应症为类风湿关节炎;后又于2018年获得FDA批准被用于治疗某些患有中度至重度活动性类风湿关节炎的成年患者;2019年礼来递交的巴瑞替尼片又获批准在中国上市。在今年5月,巴瑞替尼还被FDA批准用于COVID-19住院/重症患者。
巴瑞替尼上市时间轴

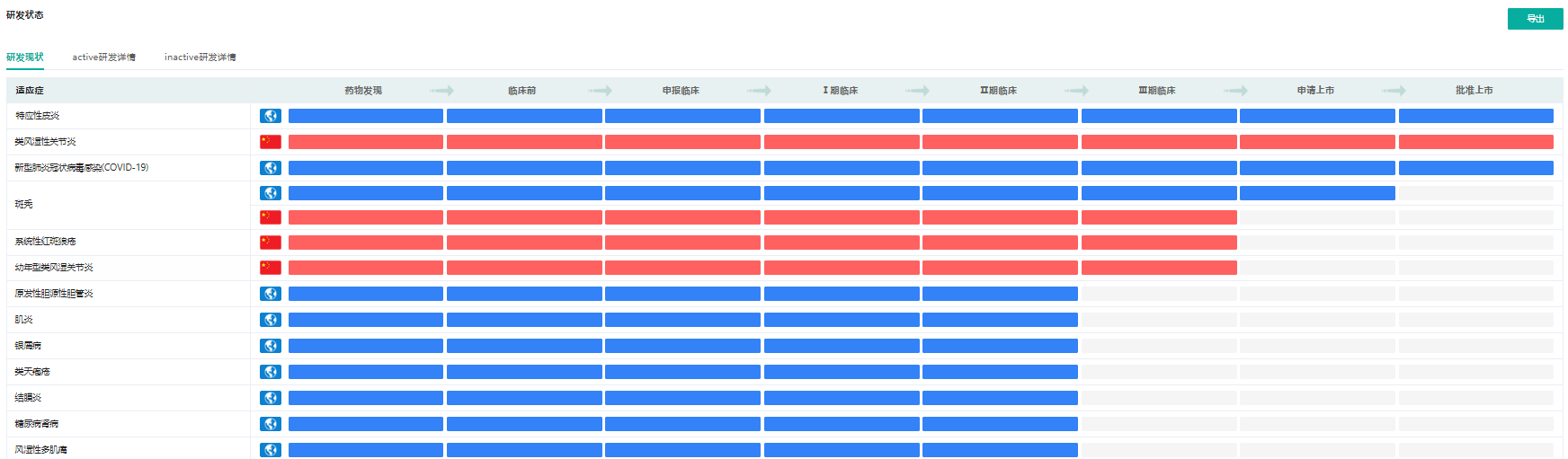
截图来源:药融云全球药物研发数据库(新版)
据药融云统计,巴瑞替尼的全球销售额自上市后一直处于持续递增趋势。2021年首次突破十亿大关,达到11.15亿元,同比增长74%。据弗若斯特沙利文预测,未来国内JAK抑制剂将持续快速增长,而巴瑞替尼作为JAK抑制剂的优势品种,未来潜力巨大。
巴瑞替尼的全球销售情况

截图来源:药融云全球药物研发数据库(新版)
巴瑞替尼治疗斑秃的疗效和安全性在两项随机、双盲、安慰剂对照试验(试验 AA-1 和试验 AA-2)中进行了研究,试验对象为经Severity of Alopecia Tool测试头皮脱发率至少达到50%且超过6个月的患者。这些患者被分组每天接受安慰剂、2毫克巴瑞替尼或4毫克巴瑞替尼的治疗。两项试验疗效的主要衡量标准是第36周时头皮毛发覆盖率至少达到80%的患者比例。
在试验AA-1中,接受2毫克巴瑞替尼的184名患者中的22%和接受4毫克巴瑞替尼的281名患者中的35%获得了达标的头皮毛发覆盖率,这个比例在接受安慰剂的189名患者中为5%。在试验AA-2中,接受2毫克巴瑞替尼的156名患者中的17%和接受4毫克巴瑞替尼的234名患者中的32%获得了达标的头皮毛发覆盖率,相比之下,接受安慰剂的156名患者中仅有3%达标。
关于巴瑞替尼的黑框警告
JAK激酶( Janus激酶)家族包括JAK1、JAK2、JAK3和TYK2四个成员,其介导的JAK-STAT通路是人体最重要的炎症通路之一,与多项自身免疫性疾病的发病相关。通过干扰酶信号通路,JAK抑制剂可用于帮助治疗癌症和炎症性疾病。但由于JAK激酶参与介导多种细胞因子的信号传导,泛JAK抑制会给患者带来多种不良影响乃至严重的副作用。和市面上多款JAK抑制剂一样,巴瑞替尼也被添加了FDA对安全性最严重的黑框警告,提示该药物有引起严重感染、死亡、恶性肿瘤、主要不良心血管事件和血栓形成的风险。
参考来源:
[1] FDA官网
[2] 药融云数据库
[3] FDA增加JAK抑制剂严重副作用警告—Janus神的双面性
想要解锁更多药物信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、申报情况、审批情况、上市情况、最新进展、市场竞争格局、销售情况、市场规模与前景,可否投入仿制与研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论