导读
近日,国家药审中心的赵娜、石靖、许真玉、李珊珊老师在《中国新药杂志》上刊登了一篇《化学药品注射剂灭菌工艺研究及验证的基本考虑》,旨在对《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》做进一步的说明。本文是笔者对这个“基本考虑”进一步的解读。
摘要
2020 年12 月,国家药品监督管理局药品审评中心(以下简称药审中心) 公布了《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》。本文结合该指导原则的起草和修订,对湿热灭菌工艺的重要概念、灭菌工艺选择的决策树进行了阐明,对湿热灭菌工艺研究和验证中的关注点进行了讨论,对修订要点及新增内容进行了分析和梳理,旨在为后续化学药品注射剂仿制药一致性评价的研究提供更多的参考。
点评
这篇文章可说是试行一年以来,官方对《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》的一次全面解读。全文对指导原则撰写时参考的文献进行了列举,对思路进行了阐释。但是就和指导原则原文一样,官方的东西总是“点到为止”,懂得自然懂,不懂也不知道人家说什么。笔者尝试对这篇文章背后的东西做一些深度的解读。
正文
无菌保证水平( sterility assurance level,SAL) 是注射剂的关键质量属性之一,在注射剂研发、审评、生产和上市后监管各个环节均需要给予充分的关注。技术要求方面,《化学药品新注册分类申报资料要求(试行)》[1]、《化学药品注射剂仿制药质量和疗效一致性评价技术要求》[2]、《M4: 人用药物注册申请通用技术文档(CTD)》模块一文件及CTD 中文版[3]对于无菌制剂或注射剂的申报,均要求提供相应的灭菌/无菌工艺验证资料,并提到:“注射剂灭菌/无菌工艺的研究和选择应参考国内外灭菌/无菌工艺相关的指导原则进行。”为了规范无菌药品研究和验证工作,2008年原国家食品药品监督管理局发布了《化学药品注射剂基本技术要求(试行)》(以下简称7号文)[4]。原国家食品药品监督管理总局药品审评中心(以下简称药审中心)于2013年2月形成《灭菌/无菌工艺验证指导原则(征求意见稿)》[5](以下简称2013年征求意见稿) ,但一直未正式发布; 2018 年国家药品监督管理局发布了由食品药品审核查验中心组织起草的《除菌过滤技术及应用指南》、《无菌工艺模拟试验指南(无菌制剂)》等指南[6]。湿热灭菌法作为一种主要的最终灭菌工艺,灭菌能力强,为热力灭菌中最有效、应用最广泛的灭菌工艺,也是灭菌工艺选择时优先选用的灭菌工艺。近年来,国外化学药品注射剂灭菌工艺验证的相关技术要求已不断完善,欧美均有对于灭菌工艺验证的相关要求,如美国注射剂协会( Parenteral DrugAssociation,PDA) 的系列技术报告1号《湿热灭菌程序的验证: 灭菌程序的设计、开发、确认及日常监控》、30号《采用湿热灭菌法的最终灭菌药品及医疗器械的参数放行》和48号《湿热灭菌设备系统: 设计、试车、运行、确认和维护》[7],欧洲EMA于2019 年发布了《制剂、原料药、辅料和内包材灭菌指南》[8]等。目前,我国灭菌工艺验证的要求仍以药品生产质量管理规范( GMP)[9]和7号文为基础。为促进化学药品注射剂仿制药一致性评价工作的顺利开展,结合最新的技术要求,药审中心组织起草并发布了《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(征求意见稿)》(以下简称指导原则) [10]。本文结合该指导原则起草和修订过程,对湿热灭菌工艺研究和验证中重要的概念、关注点及新增的内容等进行阐述和讨论,旨在为业界理解和执行指导原则提供一定的帮助。
点评
全文开端第一个词就是“无菌保证水平”,这是整篇指导原则的核心,也说明了现在审评机构对于灭菌工艺筛选的重视。后文大量罗列国内外的参考文献,先国内,再国外。列举的这些,推荐大家阅读其中两个,美国注射剂协会( Parenteral DrugAssociation,PDA) 的系列技术报告1号《湿热灭菌程序的验证:灭菌程序的设计、开发、确认及日常监控》及欧洲EMA2019 年发布的《制剂、原料药、辅料和内包材灭菌指南》。前者从灭菌科学讲起,继而引出种种概念,逐渐让人理解现在灭菌工艺选择和验证方式的原理和科学依据,可以说的世界各国制定法规都首先要参考的根本性指南。后者则是现在世界上最先进的应用性指导原则,对不同种类产品,不同的灭菌方式,以及如何选择灭菌方式,都有详尽科学的阐述。打个比方,PDA的报告是九阴真经的上卷,讲内功的;EMA的指南就是九阴真经的下卷,讲招式的。二者齐读,奇经八脉都可打通。另外推荐一个没有被CDE列出的指南,即日本厚生省的《通过最终灭菌方法生产无菌药物的准则》。这个日本的指导原则可以说是对EMA指南补充得恰到好处,其对“基于产品特性的灭菌工艺”这一点如何应用,讲得比EMA指南更加具体,且有实例。那么为什么CDE撰写的时候唯独没有参考日本的指南呢?这是因为日本灭菌工艺选择的思路比较特殊,其没有决策树这个概念,这与CDE的根本理念不符。另外,“基于产品特性的灭菌工艺”这一点,在国内被简化成了“残存概率法”。因此,日本的指南,CDE是真的没怎么参考。
至于国内这个《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》,我的理解就是速成版的九阴真经,就是周芷若练了几个月学会了九阴白骨爪那一版。这是黄蓉考虑到迅速提高将士战斗力的需要,殚精竭虑写出来的。国内版的灭菌指导原则也是CDE专家考虑到国内的接受能力,将EMA的指南加以简化,弄出来的速成版。那么这个速成版简化了哪些内容呢?我们后文一一阐述。
1. 灭菌工艺的概述
本文重点对注射剂常用的灭菌工艺(即湿热灭菌工艺)的研究和验证进行阐述。其他无菌药品如无菌原料药、滴眼液和无菌半固体的研究和验证过程中,一定程度上可参考本指导原则,同时基于产品、剂型、工艺的特性,还会涉及其他方面的考虑。
点评
简化的两个点,剂型范围和灭菌方式。EMA的指南包含了制剂、原料药、辅料和内包材灭菌,国内指南是配合注射剂一致性评价的大背景出台的,对该项工作进行指导。因此只包括注射剂和湿热灭菌。其他剂型的研究和验证,在理念上可以参考,在实操上还是多读读国外其他指南的好。
2. 湿热灭菌工艺的研究
2.1 注射剂灭菌工艺选择的决策树
图1 注射剂灭菌工艺选择的决策树
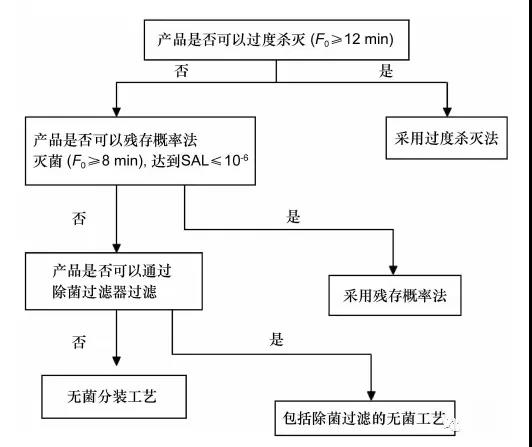
点评
简化的又一个点。EMA的指南包含了三个灭菌决策树,除了水溶性产品的决策树外,还包括干粉产品、非水溶性液体或半固体产品的决策树以及容器的灭菌选择决策树。
指导原则中注射剂灭菌工艺选择的决策树与其他国家或地区执行的决策树存在一些差异: EMA 指南的灭菌决策树将《欧洲药典》5.1.1灭菌条件( ≥121 ℃,≥15 min)作为第一个可行的选择,其次是标准灭菌时间(F0)≥8min的灭菌工艺,无过度杀灭工艺的选择项。美国FDA 指南的决策树是以过度杀灭工艺作为第一个可行的选择。PDA 的报告中过度杀灭工艺被定义为“一个被灭菌产品获得F0PHY( 物理杀灭时间) 和F0BIO (生物杀灭时间)至少为12 min 的灭菌程序”,其他的灭菌程序被定义为“基于产品特性的灭菌工艺”,但是并未规定具体F0值。由于我国自7号文实施之后,业界均已经广泛接受了7号文对2种湿热灭菌的定义,且已经过很长时间的实践,相关的研究和验证要求如果足够完善,也能够有效保证工艺的无菌保证水平,因此指导原则仍建议沿用原来的定义,仅在研究和验证要求内容上进行了调整。
点评
这部分内容信息量非常大,讲的是灭菌决策树制定时的考虑。回顾一下历史,其实灭菌决策树这个概念远比我们想象的要年轻,他首先是来自于99年欧盟《药物开发指导原则》的一个附件。后来在2007年国家审评中心的霍秀敏老师在CDE网站上发表的一篇文章,首次介绍了欧盟的灭菌方法选择决策树。当时的决策树是这样的:
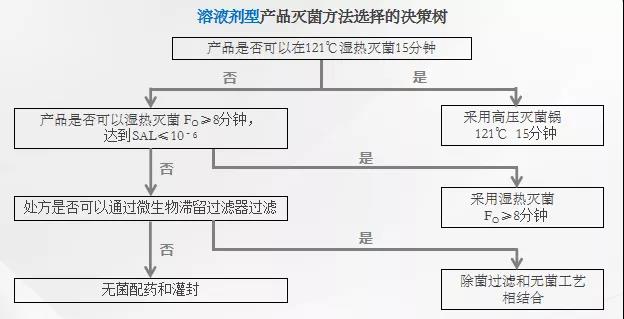
这个决策树也是2019版EMA指南的灭菌决策树。与国内最终确定的决策树相比,121℃,15min是首选。我怀疑这个条件来自于PDA另一篇技术报告中所提到的“半周期法”。这种方法是在灭菌柜冷点的位置放置了初始细菌计数为106 CFU的生物指示剂,其灭菌时间是所有生物指示剂死亡时间的两倍。初始细菌计数为106 CFU的生物指示剂的存活概率在7 min时为10%,在8 min时为1%,因此(7 min至8min)×2=14min至16min,平均值即15min。CDE的专家将这个首选条件变更为F0>12的过度杀灭,我是非常赞成的。F0>12本身已经是过度了,F0>15实属过度的过度,没有必要。
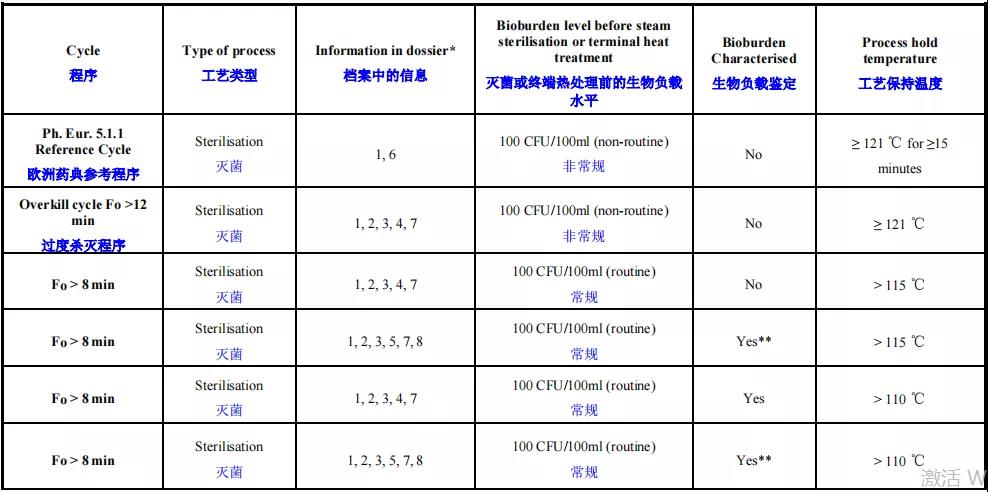
另外就是7号文对2种湿热灭菌的定义,F0>12的过度杀灭法及8<F0<12的残存概率法,这个概念还是来自于欧盟。这里紧接着来了一句PDA报告中其他的灭菌程序被定义为“基于产品特性的灭菌工艺”。这是什么意思呢?CDE的老师就是不肯把话说明。其实就是8<F0<12的残存概率法属于基于产品特性的灭菌工艺!说起来有点乱,我们捋一下。PDA报告将灭菌工艺分成两种:F0>12的过度杀灭法和基于产品特性的灭菌工艺。EMA指南的决策树是121℃,15min和F0>8的残存概率法,看似和PDA的分类不吻合,其实实质是一致的。EMA降灭菌工艺分成多个情形,如下:
在这个表里,从第三行开始到最后都属于“基于产品特性的灭菌工艺”。不同的灭菌工艺,验证或者说申报时需要做的研究有很大的不同。灭菌温度越低,F0值越低,需要了解的内容(如菌种的鉴定,药液的微生物负载水平)就越多。为促使申请人主动提高无菌保证水平,EMA单独将F0>8列出来放在决策树中。与EMA指南相比,国内的指导原则分得就没有那么细了。F0<8的情形完全没有涉及。
EMA的指导原则中,建议了湿热灭菌法的最低保持温度,即所有湿热灭菌工艺都要求最低保持温度为110℃。通过较低的温度和较长的灭菌时间也可以获得目标F0值,但可能会影响耐受性较强的污染菌的杀灭效果,无法满足无菌保证水平,因此要求进行论证。考虑到部分产品灭菌过程中无明显的保温平台期,规定最低保持温度不适用于所有产品,因此在物理确认和生物学确认均能够满足要求的条件下,基于当前的认知,没有对灭菌程序的设计做更具体的规定。
点评
一句“基于当前的认知”,道出了多少差距!这段话我们做三点解读。
(1)为什么EMA规定湿热灭菌工艺最低保持温度为110℃?在PDA的报告中介绍了灭菌率的概念。灭菌率是指某一温度T(℃)下灭菌1min所获取的标准灭菌时间(121℃下的灭菌时间)。L(T,Z)=10(T-Tref)/Z ,Tref指标准灭菌温度(121℃)。例如:在Z=10℃的指示系统,温度120℃灭菌1min,计算灭菌率L=0.79,相当于121℃下灭菌0.79min。同理可算得110℃灭菌1min,相当于121℃下灭菌0.08min。再低的灭菌温度几乎就累计不到F0值。在无菌保证水平和产品稳定性这架天平上,在110℃基础上继续降低温度几乎不会带来任何益处。
(2)如果污染菌的D值较高(D值的概念见PDA报告),那么使用较低的灭菌温度,延长灭菌时间来达到F0>8,其无菌保证水平将远不如灭个121℃,8min。因此,如果产品稳定性允许,在121℃,8min和115℃,32min这两个条件中,我们应该坚定地选择前者。
(3)“没有对灭菌程序的设计做更具体的规定”实属无奈之举。照搬EMA的要求,“基于当前的认知”,实在是无法做到。
F0值通常从加热阶段的100℃开始累积,结束于冷却阶段的100 ℃,因为饱和蒸汽灭菌的状态是整个过程中存在液态水,而100℃为水变为蒸汽的临界点[11]。PDA 的第1号技术报告也推荐F0 值开始计算温度为100℃,湿热灭菌器的数据采集系统也一般设计为从100℃开始计算F0值,因此F0值计算的起始温度实际是基于已经达成的共识。灭菌温度由100℃上升至110℃,该阶段时间间隔约1min,对F0值贡献约为0.1,对产品累计F0 的计算不会产生较大影响,但是更宽泛的F0值积分范围对反应灭菌程序升温和降温的工艺稳定性方面是有意义的,因此不再特别界定。目前的湿热灭菌工艺仅包括过度杀灭法和残存概率法2 种,不包括F0<8的最终热处理工艺(即无菌工艺后最终热处理)。F0<8的热处理程序为一种减弱条件的最终热处理方式,虽然能起到一定的灭菌效果,但不足以单独作为最终灭菌工艺提供符合要求的无菌保证水平,因此不进行过多讨论。
点评
F0<8的热处理程序不做过多讨论。其实参照PDA报告及日本的指南,完全可以在测定污染菌D值及定期监控的基础上,用F0<8的热处理程序达到无菌保证水平<10-6的效果。只要能充分证明产品不能耐受终端灭菌,目前CDE也并不禁止F0<8的热处理程序。有技术实力的企业完全可以尝试测定污染菌的D值,并依照国外指南设计热处理程序。申报上去预计审评老师会无视,但或许对企业的印象分会增加。
2.2 湿热灭菌工艺的选择依据
灭菌工艺的选择一般按照灭菌工艺选择的决策树进行,湿热灭菌工艺作为一种主要的最终灭菌工艺,应优先选用。湿热灭菌方法主要包括过度杀灭法和残存概率法,具体选择哪种灭菌工艺在很大程度上取决于待灭菌产品的热稳定性。影响产品热稳定性的因素,除了与药物活性成分的化学性质相关外,还与制剂的处方工艺、包装系统等密切相关。其中包装系统的选择和设计也是影响湿热灭菌工艺条件选择和最终无菌保证水平的重要因素,在研究中应结合产品特性、包装系统的相容性以及灭菌器的灭菌原理等进行包装系统的选择和设计,并避免选用热不稳定的包装系统。在进行处方工艺、包装系统等优化的基础上,结合注射剂的稳定性数据选择合适的灭菌工艺。参照EMA 指南,在稳定性数据评估时应关注降解杂质的研究,对于一般降解杂质不应仅因其含量超过ICHQ3A,Q3B 指导原则[12-13]规定的限度,就排除湿热灭菌工艺而不进行论证,如果一般降解杂质经研究确证为代谢产物或其含量水平在可接受的范围内,仍推荐采用湿热灭菌工艺。随着公众对药品安全性要求的提高,致突变杂质也要作为一个考虑的因素,若降解杂质具有警示结构,应参照ICH M7指导原则[14]和国内外监管机构的要求进行研究,并考察灭菌温度和时间对杂质降解速率的影响,作为灭菌工艺及灭菌条件选择的重要因素之一。随着化药药品注射剂仿制药质量和疗效一致性评价工作的开展,注射剂仿制药灭菌工艺的选择成为关注的热点。一般而言,在无菌保证水平不低于参比制剂的基础上,仍可以按照灭菌工艺选择的决策树进行灭菌工艺的选择。
点评
苦口婆心地讲道理,让企业尽可能提高无菌保证水平,这点与EMA的思路和要求是一致的。最后一句话的意思是灭菌工艺的筛选可以在一定程度上抛开参比制剂来进行,无菌保证水平可以比它高,不能比它低。注射用奥沙利铂被移除参比制剂目录,显示了监管部门的决心。
2.3 微生物污染的监控
指导原则基于《中华人民共和国药典》2020年版[15]对微生物污染监控的方法等进行了相应内容的完善与修订,将“微生物污染的监控”作为独立的一项内容进行了系统的阐述。指导原则明确了过度杀灭法和残存概率法对微生物污染监控要求的区别; 要求微生物污染水平的监测、耐受性(DT值)的测定等参照《中华人民共和国药典》2020 年版相关通则进行; 另外,体现了“质量源于设计”的理念,提倡在工艺设计阶段筛选有效的措施,降低灭菌前微生物污染水平,因此湿热灭菌工艺也通常会包括“降低灭菌前微生物污染的工艺设计”内容。
点评
提到了2020版药典收录了D值测定的方法。做微生物检测工作的也可以学习一下PDA报告中的测试方法(直接计数法和阴性分数法),并与药典进行对比,必有收获。
3.湿热灭菌工艺的验证
湿热灭菌工艺的验证一般分为物理确认和生物学确认2部分,物理确认包括热分布试验、热穿透试验等,生物学确认主要是微生物挑战试验。
3.1 物理确认
在物理确认时,应基于风险评估的原则,综合灭菌器的几何形状、空腔尺寸、产品装载方式以及试验确认的冷点、热点等确定温度探头的个数和安装位置,如热穿透试验时整个包装中最难灭菌的位置应安装温度探头,并通过图表或照片等方式对产品装载方式及探头放置合理性进行说明。热分布和热穿透试验数据的分析处理应确认关键和重要的运行参数,并有相应的文件和记录。考虑到实际生产中灭菌设备、待灭菌产品的情况复杂和多样性,指导原则只推荐了需要关注的主要参数,未明确主要参数的可接受范围。实际生产中应结合灭菌条件、灭菌设备的特点以及产品的实际情况综合分析拟定运行参数的合格标准,一般根据获得的数据,综合评估整个灭菌程序的实际控制情况。
点评
“指导原则只推荐了需要关注的主要参数,未明确主要参数的可接受范围”。确实非常复杂,光是一般灭菌验证中“最冷、最热点和平均温度之间的温差应不超过2.5℃。保温时间内温度波动应在±1.0℃之内”这种参数的设置,难以满足诸多产品的实际要求。建议关注(1)缩短灭菌柜平衡时间(升温时间);(2)缩短灭菌柜降温时间;(3)减小柜内实际温度与设定温度的偏差;等三点,对于大部分品种,都是有益的。
3.2 生物学确认
生物学确认时,根据待灭菌产品和灭菌工艺选择合适的生物指示剂尤为重要,随着《中华人民共和国药典》2020年版的实施,生物指示剂的选用可以直接参照《中华人民共和国药典》2020 年版四部通则9207“灭菌用生物指示剂指导原则”。在使用生物指示剂时,除了对生物指示剂的主要质量参数,如总芽孢数、DT 值和存活时间、杀灭时间等进行评估或测定外,还应对实际条件下生物指示剂的耐受性进行评估,因为生物指示剂所处的载体或溶液可能对其耐受性有影响,如嗜热脂肪地芽孢杆菌在含氯化钠或氯化钾的溶液中耐受性会增强,故要求无论是直接使用市售的生物指示剂成品,还是将生物指示剂接种到待灭菌产品中,均应考虑待灭菌产品对细菌芽孢耐受性的影响,如果待灭菌产品会使细菌芽孢的耐受性增加,应采用直接接种到待灭菌产品的方法。生物指示剂的接种量( 即灭菌前生物指示剂的初始芽孢数,N0 ) 的计算方法是根据相关文献[16],参照PDA 的第1号技术报告确定,并要求特殊情况下,若选取灭菌后生物指示剂的存活芽孢数(NT)<1 计算N0,应提供合理性说明。进行试验结果的评价时,除了根据生物指示剂的DT 值、接种量外,还需结合挑战试验验证结果及产品灭菌前微生物的污染水平(耐受性及微生物污染数量)来评价产品在验证的灭菌条件下实际达到的SAL 值。
点评
“还需结合挑战试验验证结果及产品灭菌前微生物的污染水平(耐受性及微生物污染数量)来评价产品在验证的灭菌条件下实际达到的SAL 值”这句话不太好懂。建议读PDA的报告,也建议读日本厚生省的《通过最终灭菌方法生产无菌药物的准则》,对于D值对SAL 值的影响,将会有更深的理解。
3.3 过度杀灭法进行生物学确认的必要性
7号文提及大容量注射剂可不进行生物学确认。EMA指南明确《欧洲药典》5.1.1灭菌条件(≥121 ℃,≥15 min)不要求提供灭菌工艺验证资料。实际EMA 指南附件1表中,除了特殊情况(即《欧洲药典》5.1.1灭菌条件),其他湿热灭菌工艺(包括过度杀灭工艺) ,均要求提供F0PHY和F0BIO验证资料,即应进行物理确认和生物学确认。同时,美国FDA 的“无菌工艺验证资料的申报要求”[17]明确要求最终灭菌工艺应进行生物学确认,证明任何一个灭菌工艺能达到10-6或更好的无菌保证水平。对于蒸汽或热穿透困难的产品来说,仅凭物理确认获得的温度、时间或F0值等数据尚不足以证明被灭菌产品已经达到灭菌要求。同时,对于产品的难灭菌部位,如注射剂的内腔、针头的保护罩或滤膜等也不能仅通过物理确认证明已经达到灭菌要求。因此,基于决策树对灭菌工艺的分级,应要求物理确认和生物学确认结果一致,两者相互确证,且不能相互替代。
点评
与EMA的理念一致。当然,在采用121℃、15min灭菌条件的情况下,EMA不要求提供生物学确认。其他情况,包括过度杀灭法,生物学确认的资料是必不可少的。
3.4基于风险评估的验证方案设计
灭菌工艺验证时,通常存在不同灭菌器(一般指相同工作和设计原理的灭菌器) 、处方组成、容器规格、装量、装载方式等情况,若每种情况都进行验证需要大量的实验和昂贵的成本。从减少验证试验数量,节约验证成本方面考虑,参照欧盟及美国监管理念,指导原则增加了“基于风险评估的验证方案设计”内容。在不牺牲无菌保证水平的前提下,在风险评估的基础上,经综合考虑各方面因素且通过充分的合理性论证后,可选用具有代表性的灭菌器、待灭菌产品和装载方式等进行灭菌工艺验证,不必对所有情况进行验证,如耐热性、黏度最大产品的灭菌验证可代表低水平产品,最大、最小浓度处方产品的灭菌验证可代表中间浓度产品,最大装量的最大容器和最小装量的最小容器产品的灭菌验证可代表中等规格及中等容器的产品等。
点评
品种比较多的注射剂生产企业应该对此已经很熟悉了。
4.总结
湿热灭菌工艺研究和验证为《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》的重要组成部分,该指导原则在2013 年征求意见稿的基础上,结合国内外灭菌工艺研究及验证相关法规指南的更新及国内湿热灭菌工艺的发展[18-20],对部分内容进行了修订,同时增加了一些与国际接轨的验证理念,如基于风险评估的验证方案设计等,目的为形成统一的针对化学药品注射剂灭菌工艺研究及验证的技术要求,为促进化学药品注射剂仿制药质量和疗效一致性评价的顺利开展提供技术支持。
点评
希望我国制药研究和工业水平尽早提升,监管部门也能适宜地推出本指南的升级版。速成版的九阴真经只是权宜之计,我们想要的是全本!






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论