
近日公司做了一个注射剂项目,大家就注射剂灭菌验证中物理确认的一些问题出现了分歧,恰巧此部分知识正处于笔者知识盲区,由此翻阅了相关法规文件并浏览了多个技术论坛,对热穿透及热分布相关的常见问题进行了汇总,分享给大家一起学习讨论。
1.什么是热分布及热穿透试验?
热分布试验,通常分为空载热分布和装载热分布。空载热分布是在灭菌设备空载的条件下,利用温度探头记录整个灭菌过程中灭菌室内不同部位的温度,找出“冷点”与“热点”,监控温度变化及温度差异,其目的是为了确定灭菌介质温度分布是否均匀且能否保持稳定。装载热分布则是为了探寻装载条件下灭菌室内温度分布情况,与空载热分布相比,转载热分布情况受到灭菌物品装载量及装载方式的影响。
热穿透试验,热温度探头要插入灭菌样品中,监测灭菌过程中样品内温度与F0值,目的是确认该灭菌程序下产品内部能够达到预期的灭菌效果,并同时能够保证灭菌产品不会因热点温度过高而出现质量变化,确保灭菌过程产品质量的均一性。
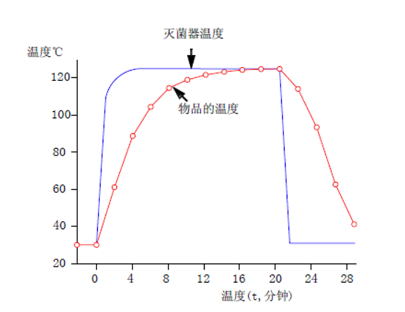
图1 时间-灭菌温度曲线
2.冷点如何定义?
冷点在热分布及热穿透试验中代表的意义不同,热分布中冷点是指灭菌过程中平均温度最低的区域,是对灭菌器性能的评估。通常来讲,空载热分布的冷点区域会比较固定。但是,近年来由于灭菌设备的更新换代,性能不断被提升,空载热分布冷点温度与其他位置温度差距逐渐缩小,甚至可能3次试验冷点并不出现在一处的情况,因此也有将出现频率最高的温度低点作为冷点的做法。
对于热穿透试验,冷点则是指该灭菌样品中F0最小的区域,代表的是灭菌程序能否达到预期的灭菌效果,以保障产品的SAL≤10-6,验证的是灭菌程序的性能。
3.热分布探头如何布点?
空载热分布探头的数量与位置的确定取决于灭菌腔室的性状及尺寸要素,装载热分布试验则要结合空载热分布的结果,并综合考虑装载量及装载方式的影响。
对于探头数量的选择, 《药品GMP指南(第2版)》中推荐“一般至少选择10个温度探头”。对于小型灭菌设备,多数厂家通用的是16个探头。
技术论坛中有站友发了一个欧盟和中国广泛应用的灭菌设备探头数量的计算公式:

以上公式计算结果只进不舍。由于未找到文件依据,请大家甄别后使用。
对于探头的布点,《药品GMP指南(第2版)》建议如下几个位置应有探头:灭菌室几何中心与角落、可能的冷点位置、设备自带探头位置、冷凝水排水口的探头位置,探头应在灭菌腔室内中有代表性的水平和垂直平面上按照几何分布。
《注射剂灭菌器》国家标准里推荐灭菌腔室温度探头摆放位置的示意图如下:
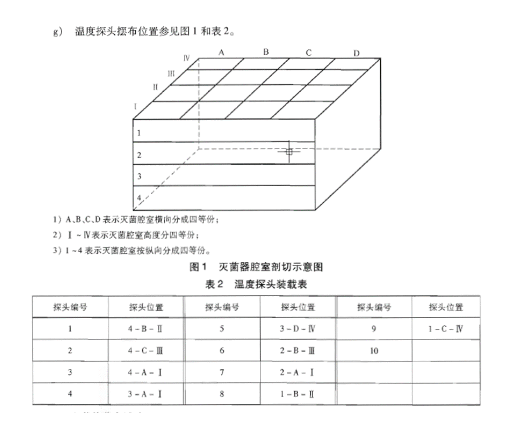
图2 《注射剂灭菌器》国家标准中温度探头摆放位置示意图
根据中国医药设备工程协会发布的《水浴灭菌柜选型用户需求》中的要求,工厂现场测试进行温度分布研究时,建议每立方米的温度传感器数量不少于1个。图3中探头分布方式可作为灭菌方法开发阶段的一个参考。

图3 《水浴灭菌柜选型用户需求》探头布点内容截图
4.热穿透样品内探头如何放置?
热穿透实验中,探头位置可参考装载热分布试验数据并参考风险评估结果,确定探头在灭菌柜中的空间位置摆放。与热分布不同,热穿透探头应该插入样品中。
热穿透的冷点是容器中F0最低的位置。对于大容量注射剂来讲,产品几何中心底部一般是低温点,即冷点所在位置;而对于小容量注射剂而言,由于体积较小,溶液内升温速度差别不明显,因此并没有典型的冷点位置。

图4 液体容器中探头位置示例
5.安瓿瓶如何进行热穿透试验?
安瓿瓶中无法放置探头,可以采用相同规格的西林瓶进行热穿透试验。通常上认为同规格条件下,西林瓶瓶壁较安瓿瓶厚,如若西林瓶的热穿透试验结果满足要求,则安瓿瓶也可以达到此效果。这也是行业内普遍接受的做法。
CDE发布的《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》中提到,对于小容量注射剂可考虑探头放置在容器外,但是必须证明放在包装外的探头数据也能反应产品的灭菌效果。
此外,对与小于20ml的安瓿瓶,《注射剂灭菌器》JB/T20001-2011里面的温度控制试验内容有提到可以免做热穿透。
不同审评老师的审评尺度不一,在蒲公英论坛上就有小伙伴反应,有老师提出将安瓿瓶掰开后将探头插入进行热穿透试验。因此,出于稳妥考虑,还是建议进行热穿透试验,避免老师从这个角度指出缺陷。
6.热穿透的模拟样品如何选择?
热穿透试验的模拟样品一般应为实际生产的样品,很多厂家在产品工艺验证同时进行热穿透试验,也有厂家的热穿透试验是单独于生产进行的。不管是哪种种方式,均应使用真实的样品,不建议使用纯化水等样品替代。
7.装载热分布的装载量如何确定?
对于装载条件下的热分布试验,GMP指南中使用的是“满载热分布”一词,而CDE发布的灭菌验证的法规文件中则用的是“装载热分布”,虽仅有一字之差,但是体现的完全不同的概念。
满载是设备验证时装满的批量,装载包括空载、满载、最大、最小和典型装载等情况。注射剂产品灭菌验证通常会固定装载方式,一般认为满载作为最差条件,能够覆盖常规的批量范围。因此厂家灭菌验证大多采用满载热分布试验,生产批量不足满载则用替代样品补全至满载。但如果生产批量远小于满载,且批量绝不会大于某一批量,也可只做该最大批量的验证。
一般注射剂产品小装载的无菌保证水平较大装载要高,最小装载目的主要是考察被灭菌物品的耐受性。因此注射剂灭菌较少有最小装载的验证,也有人认为空载可当做极限最小装载。
8.装载热穿透和装载热分布可以只做一个吗?
《GMP指南2023版》对于热穿透和装载热分布有如下规定,对与过度杀灭法,热穿透试验的重要性远大满载热分布试验,对热分的布温度数据不存在硬性要求。热穿透试验可以与热分布同时进行。对于残存概率法,指南建议热穿透和热分布试验分别实施。
虽然指南中认为过度杀灭条件下满载热分布数据参考意义不如热穿透试验,但出于审评风险考虑,多数厂家都是两者都做的。通常情况下,设备验证时依次做空载热分布和满载热分布,综合评估风险后再进行产品的热穿透试验。
在探头足够多的情况下,对于过度杀灭法的装载热穿透和热分布试验也可以同时进行,能够大大节省人力和时间成本。
以上为我的一些知识总结,同时也包含了一些个人见解,如有不同意见也欢迎大家一起讨论,共同进步。
参考文献
1.CDE发布的《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》
2. 《药品GMP指南(第2版)》
3.《注射剂灭菌器》行业标准JB/T20001—2011
4.《大型压力蒸汽灭菌器技术要求》国家标准GB8599-2023
5.《环境试验设备温度、湿度参数校准规范》JJF 1101-2019
6..<PDA TR01 湿热灭菌验证>2007增补
7. 中国医药设备工程协会《水浴式灭菌柜选型用户需求(基础或通用技术要求)(试行)》
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论