
当机体遭遇相同病原体感染时,有些记忆B细胞可以迅速分化为产生抗体的浆细胞来抵抗病原体的入侵,而另一些记忆B细胞则重新分化为生发中心(germinal center, GC)进行进一步的B细胞受体(BCR)高频突变和亲和成熟。由于针对流感、HIV等高度变异的病毒的广谱中和抗体往往积累了大量体细胞高频突变,记忆B细胞反复重返GC反应被认为是产生这类抗体的必要条件。然而,调控这些记忆B细胞分化命运的转录和表观遗传机制尚不清楚。
近日,中关村生命科学园内科研机构昌平实验室领衔科学家、清华大学医学院祁海教授团队在免疫学顶级期刊《Nature Immunology》发表研究论文,报道发现了记忆B细胞再分化命运调控的分子机制。
预计阅读时间:6分钟
祁海教授团队发现,记忆B细胞经历的每一次抗原刺激都被IRF4通过表观遗传印迹记录下来,并由此调控了该细胞中两个重要转录因子BLIMP1和BACH2的相对表达水平,进而决定了记忆B细胞在接受下一次刺激后分化为GC B细胞或浆细胞的可能性。BACH2和BLIMP1分别是GC B细胞和浆细胞分化所需的两个核心转录因子,它们彼此存在拮抗作用,是B细胞命运决定的基因调控网络的重要组成部分。为了在单细胞水平检测两个转录因子的表达,祁海课题组将在BACH2基因原位敲入了tdRFP的报告小鼠(BACH2tdRFP/+)与转基因报告小鼠BLIMP1-EYFP交配,获得的后代小鼠(简称为BARBE小鼠)可以用RFP监测BACH2的同时用EYFP追踪BLIMP1的表达。除此以外,作者发现在历史文献中倾向于分化成浆细胞的记忆B细胞(IgG型或者CD80+PD-L2+)表现出更低的BACH2水平和更高的BLIMP1水平,而倾向于分化成GC B细胞(如IgM型或CD80-PD-L2-)则呈现相反的趋势。这些结果说明BLIMP1和BACH2的相对水平(BLIMP-1与BACH2的比例,简写为BLIBA)与B细胞分化命运密切相关。为了探究这两个转录因子是否对记忆B细胞命运调控起决定性作用,作者构建了B细胞特异的BACH2/BLIMP1可诱导表达小鼠。他们发现,在二次应答里,如果在倾向于分化成浆细胞的记忆B细胞上时空特异地过表达BACH2,可以逆转这些细胞原有的命运,从而更多地形成GC B细胞。相反,如果在倾向于分化成GC B细胞的记忆B细胞上时空特异地过表达BLIMP1,则这些细胞很难再形成GC B细胞,反而是分化为浆细胞。这个结果说明,记忆B细胞的命运决定与它们的亚型和表面分子并无因果联系,这两个转录因子的相对表达量才是其充分且必要的条件。BLIMP-1-BACH2的相对表达量(BLIBA)随着B细胞分化和免疫反应的进程逐渐上升,但这个上升过程并非线性。为了探究其成因,作者对记忆B细胞中高表达BACH2(BACH2high)和高表达BLIMP1(BLIMP1+)的两群细胞进行了染色质开放程度高通量测序。作者发现,相比较BACH2high的细胞,BLIMP1+细胞在整体表观印迹的层面更类似浆细胞,在诸多浆细胞特异开放的位点呈现更开放的趋势,尤其是在转录因子IRF4所靶向的位点。IRF4是一个调控B细胞分化的重要转录因子,它可以直接促进BLIMP1的表达,也直接、间接地抑制BACH2表达。已知B细胞受体信号会刺激IRF4上调。作者进一步发现来自T细胞的CD40信号通路、先天刺激(如CpG信号通路)以及其他一系列的细胞因子刺激都能以一种剂量依赖的方式促进IRF4表达。高剂量刺激会导致染色质上IRF4靶向的浆细胞特异位点开放程度显著上升。作者进而利用S1PR2-CreERT2;Rosa26-Ai14小鼠模型,在免疫后第6-8天给小鼠灌胃他莫昔芬(Tamoxifen),然后在第10天和第21天分别收集同期标记上的tdTomato阳性的GC明区细胞进行ATAC-seq的分析。结果发现,第21天的细胞的染色质在IRF4靶向的、包含ISRE序列的位点开放程度更高。这一结果说明,即使是基本不转录表达 BLIMP-1的GC B细胞,仍然通过表观遗传机制在浆细胞命运决定染色质区域(包含BLIMP-1基因)记录下接受免疫刺激的历史。这些结果也解释了免疫应答后期的GC B细胞比早期GC会更多地产生浆细胞的现象。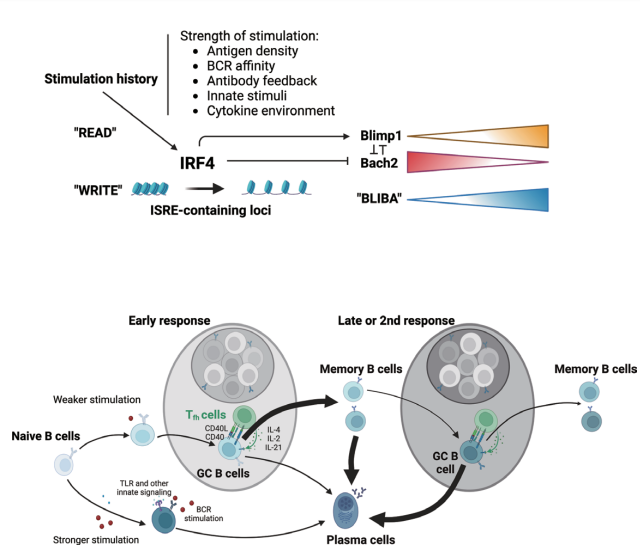
祁海团队的这一工作,发现了记忆B细胞再分化命运调控的分子机制,首次提出了表观遗传进行性记录每一个B细胞及其后代的免疫刺激史,进而影响细胞命运决定过程的理论。这一表观遗传记录过程,贯穿每一个B细胞及其后代的生活史。这项成果暗示,对于旨在诱导针对诸如HIV等变异率高的病毒的疫苗,延迟IRF4依赖的表观印迹积累,会促进疫苗诱导出的记忆B细胞再次参与GC反应,从而提高产生广谱中和抗体的可能。相关发现进一步丰富和完善了B细胞命运决定理论,为广谱疫苗的设计开发提供了底层理论支撑。昌平实验室领衔科学家、清华大学医学院祁海教授是该研究论文的通讯作者。昌平实验室副研究员王毅峰博士和昌平实验室双聘博士后、清华大学医学院博士后邵雯博士为该论文的共同第一作者。研究项目得到了科技部国家重点研发计划(项目号:2018YFE0200300)、国家自然科学基金(项目号:31830023,81621002,31900629,32200725)、昌平实验室、清华北大生命科学联合中心、北京市科学技术委员会、北京结构生物学高精尖创新中心和新基石项目的支持。
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论