
前言
抗体类药物由于其突出的特异性和亲和力目前被广泛的应用在自免疾病、肿瘤以及抗病毒治疗中,但是抗体分子在生物合成、纯化、储存以及给药后会因为各种各样的翻译后修饰导致分子结构的改变从而可能影响药效以及安全性。因此本文将对常见的异质性来源做简单的梳理。
二硫键是由半胱氨酸残基内的2个硫醇基团氧化形成。链内二硫键是在同一抗体链的两个Cys之间形成的,而链间二硫键是在重-重链或重-轻链之间形成。理论上,抗体的所有Cys残基都应该以明确的连接模式参与链内或链间二硫键的形成。二硫键相关的异质性包括游离巯基、硫醚的形成、半胱氨酸化和三硫键。
已完成配对二硫键在碱性pH下可能出现可逆的β消除,形成一个脱氢丙氨酸和一个过硫化物。过硫化物继续降解会转化为游离的巯基。游离巯基存在会导致抗体的热稳定性降低,共价聚体的形成以及药效的降低。
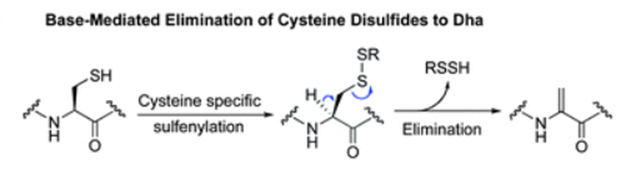
脱氢丙氨酸可以与游离的巯基反应,形成一个不可还原的硫醚键(-R-S-R’-)。大约有0.4%的抗体在0-4°储存时观察到了上述情况。有文献称LC与HC的链间二硫键(L214-H220)更容易出现β消除以及后续硫醚键的形成并且IgG1λ的反应速率比IgG1κ要更快。此外,脱氢步骤的可逆性可以导致Cys的外消旋,形成L型或D型。另一方面,脱氢丙氨酸的水解还会导致抗体铰链区碎片的形成。游离的巯基可以被溶液中的游离Cys共价修饰,称为半胱氨酸化。V区的半胱氨酸化很少被观察到,但是如果出现对抗体功能的影响是很大的。
硫键是通过在现有的二硫键中插入一个硫原子而形成的修饰(-R-S-S-S-R’-), 三硫键的形成是由于细胞培养液中存在着硫化氢。三硫键的存在不会对抗体功能产生明显的不利影响,可以通过在胞培养基中加入半胱氨酸来控制。
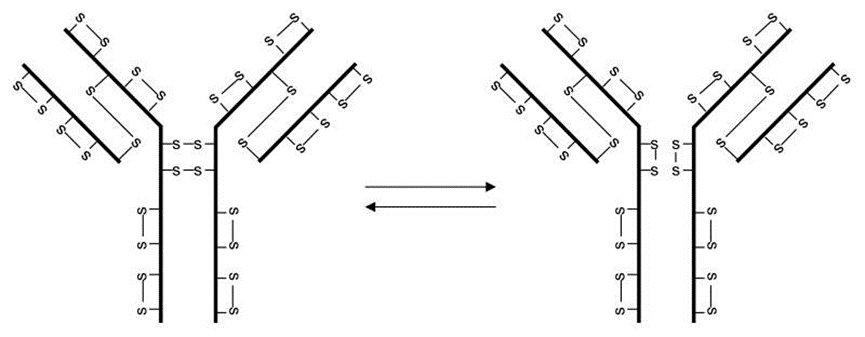
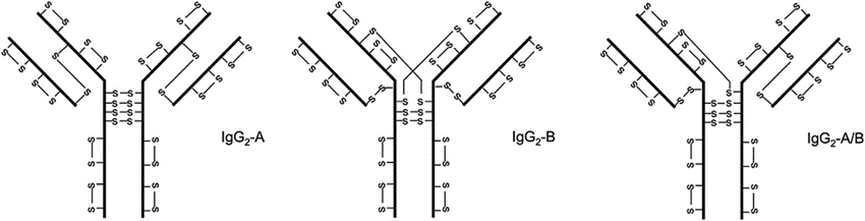
IgG2亚类中的链间二硫键在体内可以形成一对以上的组合,即A型、A/B型和B型。IgG2中经典的链间二硫键被称为A型,L链靠近或位于C端的Cys与CH1域(H链的第三个Cys)相连。在B型中,L链的C端与铰链区相连,两个CH1结构域都与铰链区相连,而在A/B型中只有一个CH1结构域与铰链相连。IgG2中二硫键形成的这种异质性最初是在重组IgG2发现的,但后来证明也存在于正常血清来源的IgG2中。这些蛋白形式的相互转化被证明是动态的,并由还原环境促进。
目前已经有很多算法来计算抗体在空间结构上的易聚集区域(aggregation-prone regions,APRs)。APRs主要是疏水性的脂肪族跟芳香族氨基酸残基(异亮氨酸、亮氨酸、缬氨酸、苯丙氨酸等 )暴露在溶剂中导致。用选定的亲水残基(如Leu309Lys)取代目标疏水性氨基酸已被证明可以产生更稳定的蛋白质,使其聚集趋势减弱。此外,传统对于ADC的认知中DAR4最优这一概念也是部分由于目前最广泛使用的MC-Val-Cit-PAB-MMAE结构高度疏水导致聚体生成而无法进一步提高DAR,在Seagen的最新专利中便展示了在通过使用β-葡糖醛酸和PEG的linker之后MMAE同样可以在低聚集的情况下达到DAR8。
游离巯基的存在也会导致共价聚体的生成,此外,抗体在最终使用时所使用的稀释剂也会对药物在体内循环时的聚体产生造成影响。赫赛汀与的使用中就明确提到需要使用0.9%生理盐水而非5%葡萄糖溶液,否则会由于补体蛋白(C3、C4和H因子)、纤维蛋白和脂蛋白在pH值6.0-6.2时与抗体结合造成不溶性聚集物。
N端化,是mAb的主要N端修饰之一。焦谷氨酸(pyroGlu)是由mAb重链(HC)和轻链(LC)的N端谷氨酰胺(Gln)和谷氨酸(Glu)的重排产生。这可以通过化学方法或谷氨酰胺环化酶来完成。N端Gln向pyroGlu的非酶性转化可导致向低分子量和低等电点的转变。在化学上,Gln到PyroGlu的环化导致N端一级胺基的丧失,因此,这些抗体的酸度会略高。Gln到pyroGlu的转化主要发生在生物反应器内,受缓冲液组成和温度的影响,对pH值的依赖性较小。磷酸钠、碳酸铵缓冲液可以增加反应的速度,水和Tris-HCl缓冲液则会降低转化速率。另一方面,Glu环化的速度要慢得多,并依赖于pH值和温度,在37摄氏度下,pH值为4.0、7.0和8.0时,mAb的L链的N端Glu的半衰期分别为4.8、19和11个月。尽管没有调查过PyroGlu形成的生物学意义,但PyroGlu的存在似乎在稳定蛋白质和肽方面起了作用,保护它们不被化学和酶降解。然而,由于没有足够证据表明N端PyroGlu的存在对H链或L链有特殊的好处,在潜在的mAb治疗的克隆选择中最好避免。
据报道,C端Lys缺失对抗体结构、热稳定性、抗原结合和效力、FcRn结合以及大鼠的药代动力学均没有影响。因此一般不被认为是一个关键的质量属性(CQA)。然而,Lys丢失会导致CEX或者CIEF等反应电荷异质性的检项图谱变化。因此,它仍然是表征中的一个重要因素。
除了Lys丢失,C端的脯氨酸还会出现酰胺化,C端酰胺化是由肽基甘氨酸α-酰胺化单氧酶(PAM)催化的,在CHO细胞的培养基中,其活性随着铜浓度的增加而增加,最高可达1μM。酰胺化被认为是一种常见的mAbs H链的C端修饰。mAbs中脯氨酸酰胺化已被证明不会降低抗体的活性、结构稳定性、体内半衰期和大鼠的皮下生物利用度。

谷氨酰胺的脱酰胺速率相对Asn来说会慢很多,有实验表面谷氨酰胺在碱性pH下更容易出现脱酰胺化,同样的,如果出现在CDR区的谷氨酰胺脱酰胺会对抗体结构与抗原结合力有显著的影响。
重组治疗性抗体的糖化可能是由于在含葡萄糖的培养基中生产、配制和最终在给病人使用前接触葡萄糖溶液而发生的。尽管制剂中用作稳定剂的蔗糖在37℃下储存时可能会因水解成葡萄糖而导致糖化,但是此种情况在2-8°保存时基本不会出现。IgG1和IgG2恒定区域的糖化已被证明不影响Fc功能,包括与FcγRIIa、FcRn和Protein A的结合;然而,位于CDR内或邻近的Lys的糖化则有可能对于抗体对抗原的结合力产生影响,此种情况可以通过将CDR区内的Lys突变成Arg避免。抗体的糖化程度可以通过修改葡萄糖喂养策略和增加细胞培养过程中的游离氨基酸和含一级胺的化合物的总浓度来控制。糖化是还原糖(如葡萄糖)和一级或二级胺之间的非酶性缩合反应。糖化反应在生理条件下发生在天然抗体和重组抗体中,并可能改变它们的电荷特性,产生酸性物质,并对其稳定性和药效产生影响。糖化反应是由易受影响的胺和碳酰(如还原糖上的醛)之间形成的席夫碱引发的,然后可以进行Amadori重排,在蛋白质和糖分子之间形成稳定的共价键。

重组治疗性抗体的糖化可能是由于在含葡萄糖的培养基中生产、配制和最终在给病人使用前接触葡萄糖溶液而发生的。尽管制剂中用作稳定剂的蔗糖在37℃下储存时可能会因水解成葡萄糖而导致糖化,但是此种情况在2-8°保存时基本不会出现。IgG1和IgG2恒定区域的糖化已被证明不影响Fc功能,包括与FcγRIIa、FcRn和Protein A的结合;然而,位于CDR内或邻近的Lys的糖化则有可能对于抗体对抗原的结合力产生影响,此种情况可以通过将CDR区内的Lys突变成Arg避免。抗体的糖化程度可以通过修改葡萄糖喂养策略和增加细胞培养过程中的游离氨基酸和含一级胺的化合物的总浓度来控制。
蛋白质氧化可以在生产过程中由作为杂质存在的金属离子和过氧化物触发,也可以由光引起。它几乎可以发生在 mAb 开发的所有阶段,例如在细胞培养、纯化、储存期间,甚至在分析测定过程中。据报道,氧化主要发生在蛋氨酸 (Met) 残基上,而较少发生在色氨酸 (Trp)、组氨酸 (His) 和其他残基上。对于IgG1与IgG2来说,Met252和Met428残基相对容易被氧化。尽管这些残基在线性序列上是遥远的,但它们在CH2/CH3界面上是接近的。这两个 Met 残基的氧化会降低了抗体的热稳定性、Protein A 结合、FcRn 结合和循环半衰期。

N-糖基化对许多真核生物蛋白质的结构和功能都很重要。前体寡糖的合成、整块转移和初步修剪发生在内质网。寡糖链的后续加工和修饰是在高尔基体中进行的。因此,糖蛋白的合成在空间上分离于不同的细胞区室。因此,合成的N糖类型取决于这些细胞区间内不同的酶对其的可及性。所有的N糖都是通过一个共同的途径和一个共同的核心聚糖结构合成的。这个核心聚糖随后被进一步细化和修改,从而产生各种不同的N-聚糖结构。虽然细菌或酵母蛋白生产系统具有显著的潜在优势,如高产量和低成本,但当目标蛋白为糖基化蛋白时,问题就出现了。大多数原核生物表达系统,如大肠杆菌,不能进行翻译后修饰。另一方面,真核表达宿主,如酵母和动物细胞,有不同的糖基化模式。在这些表达宿主中产生的蛋白质往往与人类蛋白质不一样,例如,酵母产生高甘露糖就会导致免疫原性。详细的内容我们以后会专门进行梳理。
对于目前的治疗性抗体来说,已经有足够多的分析手段来鉴别产品中的微观异质性,因此在早期开发过程中,特别要避免在CDRs内有容易降解的氨基酸残基的抗体,考察其可开发性和满足既定CQA的能力,用于评估批次间和工艺变更前后的质量可比性。因此,对于各种翻译后修饰的透彻理解对于抗体药物的临床前和临床开发以及商业化供应非常重要。
编辑人:????Transparent
公众号内回复“肿瘤免疫”或扫描下方图片中的二维码免费下载《小药说药肿瘤免疫全集》的PDF格式电子书!

公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论