近年来,越来越多的证据表明,肿瘤作为一种系统性的复杂疾病,不仅会改变肿瘤微环境与局部免疫,而且影响远处器官,扰乱全身免疫。肿瘤与免疫的平衡决定了疾病进展及治疗预后。近期研究发现,免疫治疗除了激活肿瘤局部的免疫细胞,还能唤起全身的系统性免疫反应。其中,在CD8+ T细胞亚群中,干性记忆T /耗竭前体T/组织驻留T细胞发挥着重要的抗肿瘤免疫作用。然而,具有干性的CD8+ T细胞在机体宏环境中如何响应肿瘤与免疫治疗仍然未知。

近日,国家儿童医学中心(上海)、上海交通大学医学院附属上海儿童医学中心儿科转化医学研究所PI段才闻团队与海南医科大学陈国强院士团队等共同于Nature Cell Biology发表题为《Trafficking circuit of CD8+ T cells between the intestine and bone marrow governs antitumor immunity(CD8 T细胞跨骨髓和肠道迁徙环路调控抗肿瘤免疫)》的研究成果。该研究揭示了CD8+ T细胞经历骨髓-肠道-骨髓的跨器官迁徙环路,发挥抗肿瘤免疫功能。
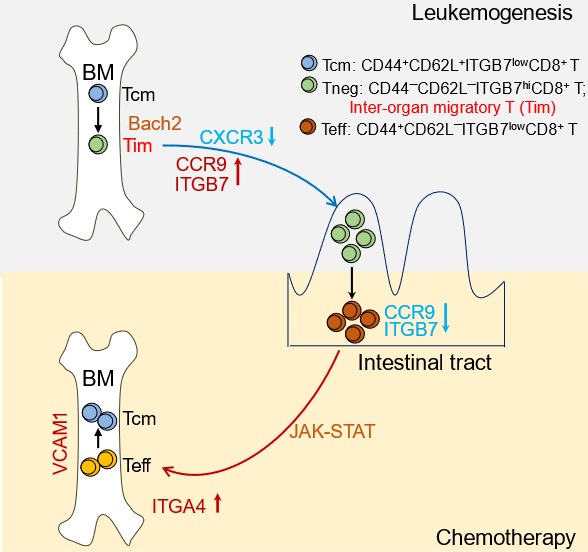
研究人员构建急性髓系白血病小鼠模型,并使用免疫原性化疗药物柔红霉素(DNR)进行化疗,发现骨髓中CD8+ 中枢记忆T细胞(Tcm)细胞数量显著增加并来自外周血液循环,参与白血病细胞杀伤。为了寻找该群细胞的来源,发现发病小鼠的小肠绒毛中聚集了大量CD8+ T细胞,且这些肠道CD8+ T细胞在化疗后显著减少并迁徙至骨髓。
CD8+ T细胞在小肠中大量聚集的现象只发生在骨髓中白血病细胞高度浸润(>80%)的情况下,与此同时骨髓中CD8+ T细胞显著减少并迁徙至小肠。为了完整观察CD8+ T细胞在骨髓和小肠之间的迁徙环路,利用光标记小鼠并结合染料标记的方法,证明了化疗前后白血病小鼠骨髓中的CD8+ T细胞经历了骨髓-肠道-骨髓的迁徙环路。
CD8+ T细胞跨器官迁徙环路模式图
此外,研究人员发现Tcm细胞需要发生表型转换,即从CD44+ CD62L+ 的Tcm表型转变为CD44– CD62L–表型,才能从骨髓迁徙至肠道。因此,具有器官间迁徙能力的CD44– CD62L– CD8+ T细胞被命名为器官间迁徙CD8+ T细胞(Tim细胞)。机制研究发现白血病高度浸润时,骨髓Tim细胞上调且依赖ITGB7与肠道血管内皮细胞MAdCAM-1的互作粘附并驻留于肠道。化疗后,肠道Tim细胞下调ITGB7,依赖JAK-STAT通路活化为Teff效应表型,同时上调并依赖ITGA4与骨髓细胞VCAM-1的互作回归骨髓。
随后,团队希望找到增强该迁徙环路的方法以进一步提高治疗效果。利用CXCR3(拮抗T细胞迁徙至肠道)敲除小鼠构建白血病模型或对白血病小鼠注射CXCR3中和抗体,发现CXCR3阻断促进Tim细胞迁徙至肠道。而化疗后骨髓中CD8+ T细胞显著增加,白血病小鼠生存时间明显延长。
综上所述,该研究发现了一群CD8+ T细胞亚群(Tim细胞)在组织间迁徙并响应机体肿瘤进展及免疫原性化疗。Tim细胞具有干性和表型可塑性,通过调节趋化因子受体和整合素在组织间迁徙并发挥重要的抗肿瘤免疫作用;该研究首次发现肠道作为CD8+ T细胞储存库,参与机体抗肿瘤免疫治疗网络的新机制。
National Children's Medical Center
作者信息
上海儿童医学中心石蓉懿博士后、周能博士和南方医院宣丽主任和江中慧为本论文共同第一作者;上海儿童医学中心段才闻研究员、海南医科大学陈国强院士、南方医院刘启发主任、上海市免疫治疗创新研究院钟怡研究员为本论文共同通讯作者。该研究得到张浩、梁爱斌、张大川、梁凯威和赵萌教授等研究人员的大力支持,也得到国家重点研发计划和国家自然科学基金委等项目资助。
原文链接:
https://www.nature.com/articles/s41556-024-01462-3
























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论