 关注小药说药,一起成长!
关注小药说药,一起成长!急性髓系白血病(AML)和骨髓增生异常综合征(MDS)仍然是一种未得到满足的临床需求。根据修订的国际预后评分量表(IPSS-R),高风险的MDS和具有不利特征的AML的预后仍然令人沮丧,这些不利特征包括年龄、既往髓系疾病、不良遗传风险和并发基因突变。事实上,具有极高IPSS-R风险的MDS患者的中位总生存期(OS)仅为0.8年,而年轻患者的新发AML患者的五年生存率为40%,大于70岁患者的5年生存率不到5%,这突显了亟需新的治疗策略的迫切性。

免疫反应的改变在AML/MDS发病机制中起着重要作用,这为免疫治疗提供了新的选择。当前,在免疫系统调节因子中,CD47、免疫检查点和toll样受体2(TLR2)是AML和MDS的主要靶点。其他几种表面分子(即CD33、CD123、CD45和CD70)的多种抗体药物形式,包括裸抗、双特异性T细胞结合器、三特异性抗体以及ADC正在研究中,作为单一疗法或与其它药物联合使用。它们代表着AML和高风险MDS治疗的未来。
免疫系统的失调可能通过多种途径影响AML和MDS的发病机制。MDS的骨髓微环境以适应性和先天性免疫效应细胞的扰动为特征,一些细胞亚型,如1型先天性淋巴细胞(ILC1)减少以及其他细胞类型,如髓源性抑制细胞(MDSC)增加。MDSCs增强了caspase-1的危险相关分子模式刺激,其通过分泌颗粒酶B和IL-10以及通过促进toll样受体(TLR)、CD33和CXCR2的信号传导来促进细胞死亡。
在AML中也观察到ILC1的功能障碍。AML细胞通过多种机制改变免疫微环境,包括免疫检查点上调和人类白细胞抗原(HLA)I类和II类下调,从而逃避免疫监控。总之,这些证据表明,先天性和适应性免疫应答的改变在AML和MDS的发病机制中起着重要作用,这也为我们提供了潜在的免疫治疗新靶点。
免疫系统调节剂正在成为血液系统恶性肿瘤免疫治疗的主要靶点,包括CD47、免疫检查点和TLR2。此外,AML和MDS细胞的其他表面分子目前正被用作单抗的治疗靶点,包括CD33、CD123、CD45和CD70。
CD47
CD-47是一种跨膜蛋白,其与信号调节蛋白α(SIRPα)的相互作用决定了对巨噬细胞介导的吞噬的抑制调节。抗CD47单抗阻断这种相互作用,从而促进巨噬细胞对肿瘤细胞的杀伤和肿瘤特异性细胞毒性T细胞的交叉启动,进而激活适应性免疫反应。
CTLA-4
CTLA-4(CD152),是属于免疫球蛋白超家族的T细胞受体(TCR)的共同受体。它在CD4+和CD8+T淋巴细胞上表达,具有抑制性免疫调节作用。CTLA-4配体是在抗原呈递细胞(APC)上表达的CD80(B7-1)和CD86(B7-2)。CTLA-4与其配体的结合阻断了与TCR相关的ζ链的磷酸化,并向淋巴细胞传递抑制信号。因此,阻断CTLA-4的活性增加了免疫系统识别和破坏肿瘤细胞的能力。
PD-1/PD-L1
PD-1(CD279),是属于Ig超家族的共抑制分子,在活化的T细胞、B细胞和髓系细胞上表达。PD-1与在肿瘤细胞和MDSC表面表达的配体PD-L1(CD274)的结合导致TCR介导的信号传导减弱。该途径同时调控诱导的T-reg细胞的发育、维持和功能。
TIM-3
TIM3是一种在CD4+T细胞和CD8+T细胞上表达的共抑制受体,通过与配体galectin-9相互作用,作为这些淋巴细胞群的负调节因子,触发细胞死亡。TIM-3在免疫和白血病干细胞(LSC)上表达,但在正常造血干细胞(HSC)上不表达;它与galectin-9的相互作用促进了LSC的自我更新,使其成为MDS/AML的一个有前景的靶点。
TLR-2
TLR2,也称为CD282,是Toll样受体家族的成员,在各种细胞表面表达,包括HSC和造血祖细胞(HSPC),并在病原体识别和先天免疫激活中发挥基本作用。TLR2的过表达导致IL-8分子途径的上调,而在MDS患者中,IL-8的分子途径常常失调。
CD33
CD33是一种唾液酸结合Ig样凝集素(Siglec),作为跨膜蛋白在恶性AML母细胞和MDS的MDSC表面表达,但在HSC上不表达。这些特征使CD33成为免疫治疗的理想靶点。
CD123
CD123是髓系多能干祖细胞上表达的IL-3受体(IL-3Rα)的α链。其与IL-3的相互作用通过JAK-2诱导细胞内酪氨酸磷酸化,促进髓系细胞的增殖和分化。IL-3Rα在AML母细胞上表达,与正常HSC相比,在白血病细胞中过表达,使其成为一个有前景的治疗靶点。
CD45
蛋白酪氨酸磷酸酶受体C型,也称为CD45,是一种跨膜蛋白,存在于几乎所有分化的造血细胞亚型。CD45是一种信号分子,调节多种细胞进程,包括细胞生长、有丝分裂细胞周期和细胞分化。CD45在AML母细胞上广泛表达,并已成为放射免疫治疗的靶点,作为异基因造血干细胞移植(HSCT)前调节方案的一部分,通过向白血病细胞传递细胞毒性有效载荷发挥其作用。
CD70
尽管CD70主要是一种淋巴系标志物,但它也在髓系白血病细胞中表达,在正常骨髓细胞中缺乏或低水平表达。AML干细胞中CD70及其配体CD27之间的相互作用诱导分子信号途径的激活,包括Wnt、JAK/STAT、Hedgehog和TGF-β信号,并促进细胞分裂。
目前几种单克隆抗体药物正在一线、复发/难治性(R/R)的AML环境中进行临床试验,这些单克隆抗体包括靶向免疫调节分子(CD47和免疫检查点)和其他膜抗原(CD33、CD123、CD45和CD70)的抗体。

CD47
目前,靶向CD47 的magrolimab正在进行的Ib期临床试验(NCT03248479),包括25名不适合大剂量诱导化疗的未经治疗的AML患者。magrolimab和HMA-氮胞苷(AZA)的联合治疗总有效率(ORR)为69%,其中50%为完全缓解(CR)或血液学未完全恢复(CRi)的完全缓解。治疗相关不良事件包括贫血(37%)、中性粒细胞减少(26%)和血小板减少(26%)。
除了magrolimab外,其他抗CD47靶向药物也在研究中。Evorpacept(ALX148)是一种融合蛋白,由靶向CD47经修饰的SIRPαD1结构域组成,与IgG1 Fc片段融合。该分子目前正在进行I/II期临床试验(NCT04755244),与BCL2抑制剂venetoclax和AZA联合用于未治疗或不符合标准诱导化疗条件的R/R AML。
免疫检查点
目前正在研究几种免疫检查点抑制剂单独或与标准疗法联合应用于AML。I期研究的数据表明,这些单抗用作单一疗法时疗效有限,与HMAs联合使用时可能产生协同效应。一项I/IB期研究(NCT01822509)测试了ipilimumab在异基因HSCT后R/R AML患者中的疗效。22例患者中有4例观察到持续响应(>1年)。值得注意的是,21%的患者具有免疫介导的毒性作用。
Sabatolimab(MBG453)是一种针对TIM-3的新型抗体,正在进行一项Ib期试验(NCT03066648)。在34例新诊断的不适合标准化疗或HSCT的AML患者中,ORR为41.2%,其中包括8个CR、3个CRi和3个PR。常见的≥3的治疗相关不良事件包括血小板减少症(45.8%)、中性粒细胞减少症(50%)、发热性中性粒细胞减少症(29.2%)、贫血(27.1%)和肺炎(10.4%)。总的来说,本研究表明TIM-3可能是一个新的有前景的治疗靶点。
CD33
2000年,FDA批准了gemtuzumab ozogamicin(GO),一种针对CD33的ADC,用于不适合化疗的CD33+复发AML。然而,2010年,GO因不可接受的毒性而退出,包括重大出血事件、感染和/或急性呼吸窘迫综合征。随后,ALFA-0701 III期多中心随机试验表明,如果GO以分次剂量给药,则具有足够的耐受性。因此,2017年,FDA批准了用于AML治疗的GO分级剂量。
此外,其它的靶向CD33的 ADC药物也在评估中。例如,vadastuximab-Taririne(VT,SGN-CD33A)正在一期试验中进行研究,以评估该药物与HMAs联合治疗先前未治疗AML的安全性和活性。
CD123
Vibecotamab(XmAb14045)是一种CD123XCD3的BiTEs,正在R/R AML患者中进行一项I期研究(NCT02730312),结果显示其具有抗白血病活性,CR/CRi比率为23%,CRS是最常见≥3的AE。
IMGN632是一种靶向CD123的ADC,正在/R AML患者中进行I/II期研究(NCT03386513)。已有结果显示33%的患者有客观反应,包括1例CR和3例Cri,没有任何与治疗相关的不良事件或死亡。
靶向CD123的不同策略还包括tagraxofusp(SL-401),tagraxofusp是一种融合蛋白,由IL-3与截短的白喉毒素连接,使蛋白合成失活。在一项一期试验(NCT03113643)中评估了tagraxofusp与AZA或AZA/venetoclax联合治疗AML的疗效,初步结果显示有良好的反应(5/9 CR,3/9 CRi)。
CD45
Iomab-B是一种与131I偶联的抗CD45抗体,在一项I期临床试验(NCT00008177)中,研究了在R/R AML患者中与氟达拉滨(FLU)的低强度调节(RIC)方案和全身照射(TBI)方案的联合应用。这项研究表明,Iomab-B可以安全地与RIC方案联合使用,以实现老年HR AML患者的完全缓解,目前正在三期SIERRA试验(NCT02665065)中进行测试。
CD70
cusatuzumab(ARGX-110)是一种抗CD70单抗。基于临床前结果,一项I/II期试验(NCT03030612)评估了单剂量cusatuzumab联合AZA在未治疗的AML老年患者中的疗效。AZA诱导LSC上的CD70表达,因此与cusatuzumab联合使用时有利于体外杀伤。10名患者(83%)实现CR/Cri,4名患者通过流式细胞术实现MRD阴性,未报告剂量限制毒性。
目前正在对以前未治疗的R/R、HR和低风险(LR)MDS进行各种基于免疫疗法的临床试验。
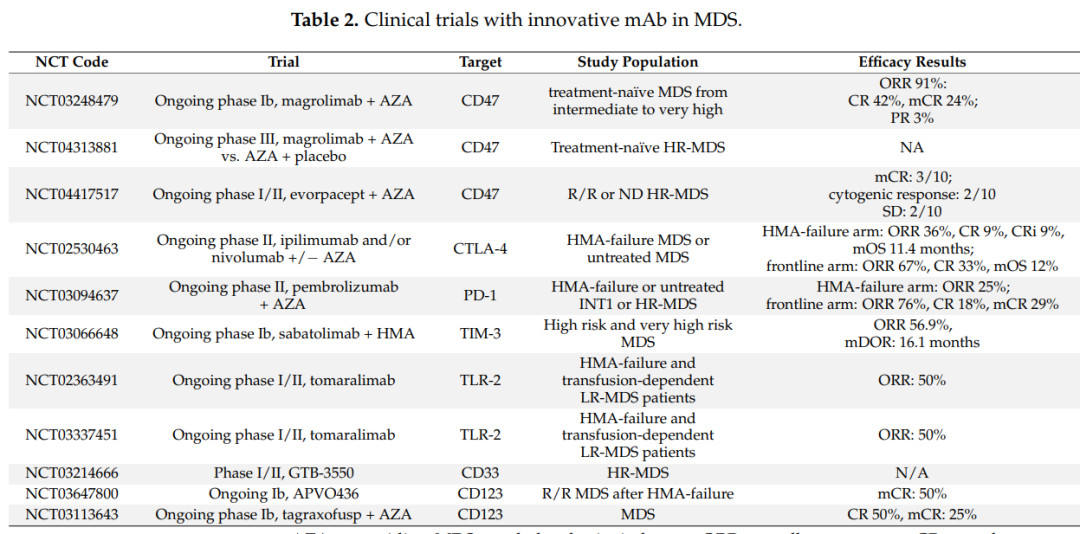
CD47
Magrolimab是治疗MDS最具创新性的药物之一。一项正在进行的Ib期研究(NCT03248479)报告了Magrolimab与阿扎联合治疗MDS患者的令人鼓舞的结果。总体ORR为91%,其中包括42%的CR、24%骨髓CR(其中一半还伴有血液学改善)、21%的血液学改善和3%PR。
免疫检查点
正在进行的II期研究(NCT02530463)分析了使用ipilimumab和/或nivolumab治疗MDS的疗效。结果显示,在HMA失败队列,ORR为36%(9%CR,9%CR/Cri,18%HI),中位OS和PFS分别为11.4和7.1个月。对于一线队列,ORR为67%(33%CR和33%HI),中位OS和PFS分别为12个月和10个月。等级≥3的不良事件包括55%的感染、46%的中性粒细胞减少、24%的皮疹和24%的转氨酶升高。这些结果表明,需要对更大的队列和更长的随访时间进行进一步研究。
TIM-3抑制性抗体sabatolimab正在进行一项Ib期临床试验(NCT03066648)。结果显示,其安全性与HMA单一疗法相似,ORR为56.9%,mDOR为16.1个月,CR可以达到21.5个月;12个月的PFS率为51.9%。值得注意的是,具有不良风险基因型(包括TP53突变)的患者的反应优于整个人群中观察到的平均反应:ORR为71.4%,mDOR为12.6个月。目前,其他多臂II期和III期研究正在进行中(NCT03066648)。
TLR-2
两项I/II期试验(NCT02363491和NCT03337451)的早期结果表明,在HMA失败和输血依赖性LR MDS患者中,使用抗TLR2的完全人源化IgG4单克隆抗体(OPN-305)具有良好的安全性和有效性。未报告明显毒性,ORR为50%,27%的患者可以不需输血。
CD33
最近的研究分析了MDS中的抗CD33双抗和三特异性抗体(TriKEs)。AMV564是一种CD33XCD3的BiTEs,在临床前研究中进行了评估,显示了体外降低MDSC和增加抗PD-1抗体活性的能力。GTB-3550是一种CD33/CD16/IL15的TriKEs,一项I/II期试验(NCT03214666)调查了GTB-3550治疗HR-MDS患者的安全性,结果显示无明显毒性,同时报告所有患者的NK活性均增加。
CD123
最近评估的CD123靶向治疗的临床试验显示了积极的安全性和有效性。CD123XCD3的BiTE (APVO436) 正在进行Ib期试验(NCT03647800)。结果未报告严重不良事件,50%达到mCR。tagraxofusp正在进行一项Ib期研究(NCT03113643),证明了tagraxofusp+AZA的安全性,最常见的≥3 的AEs包括贫血、血小板减少和中性粒细胞减少。半数患者获得CR以及25%的mCR;值得注意的是,它们都是TP53突变。
AFM28是一种新型的双特异性天然细胞接合器,靶向MDS细胞上的CD123和NK细胞上的CD16a,与传统的Fc优化IgG1抗体相比具有更高的稳定性,目前处于临床前研究阶段。
目前,只有少数AML患者使用经批准的标准治疗获得长期生存。对于非同种异体造血干细胞移植候选者的老年患者,AML的结果尤其令人沮丧,HMA加venetoclax是唯一可用的治疗。在这种情况下,开发针对不同表面分子的单克隆抗体单独或与HMA以及可能的BCL2抑制剂联合的免疫治疗新策略,可能为患者提供实质性的临床益处。
AML和MDS治疗中多种免疫治疗策略的整合仍需要大型随机临床试验来评估这些新药物的真正益处和安全性。此外,考虑到AML和MDS免疫治疗的精准医学方法,正在进行的研究还应着眼于确定特定抗体药物治疗反应的预测生物标志物。反过来,这也将为AML或MDS患者个体提供生物学上合理的特定免疫治疗策略选择。
参考文献:
1.New Frontiers in Monoclonal Antibodies for the Targeted Therapy of Acute Myeloid Leukemia and Myelodysplastic Syndromes. Int J Mol Sci.2022 Jul; 23(14): 7542.
公众号内回复“肿瘤免疫”或扫描下方图片中的二维码免费下载《小药说药肿瘤免疫全集》的PDF格式电子书!

公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论