
转载自 丁香园肿瘤时间
小细胞肺癌(SCLC)是肺癌中侵袭性最强的亚型,约占肺癌的 15%,且约 70% 的SCLC患者在确诊时已进入广泛期(ES-SCLC),生存状况堪忧[1]。近日,特瑞普利单抗联合化疗一线治疗 ES-SCLC 的 III 期 EXTENTORCH 研究(NCT04012606),以其突破性成果在肿瘤权威期刊《JAMA Oncology》上重磅发表[2],引发了全球学术界的广泛关注。值此契机,特邀湖南省肿瘤医院邬麟教授深入剖析 EXTENTORCH 研究亮点,并探讨其对中国 ES-SCLC 临床实践的深远影响。

EXTENTORCH 研究是全球首个 ES-SCLC 一线治疗达 PFS 和 OS 双主要终点阳性的 PD-1 抑制剂 III 期研究。本次 EXTENTORCH 研究结果荣登国际顶尖期刊《JAMA Oncology》,引起了广泛关注。请您为我们详细阐述一下,该研究的亮点主要体现在哪些方面?
邬麟 教授
湖南省肿瘤医院
EXTENTORCH 研究(NCT04012606)是一项随机、双盲、安慰剂对照的多中心 III 期研究,旨在评估特瑞普利单抗联合化疗对比安慰剂联合化疗一线治疗 ES-SCLC 的疗效和安全性。此前 EXTENTORCH 研究已经以口头报告的形式亮相 2023 年欧洲肿瘤内科学会(ESMO)年会,本次研究全文发表在国际顶级医学期刊《JAMA Oncology》上,再次彰显了中国研究者和民族药企的强劲实力,体现了国际同行对中国原创研究的高度认可和肯定[2,3]。
该研究的亮点众多,首先从研究设计来看,其采用了研究者评估的无进展生存期(PFS)和总生存期(OS)双主要研究终点设计。PFS 是衡量治疗方案在延缓疾病进展、改善患者生活质量等方面效果的关键指标,OS 则被视为抗肿瘤治疗临床试验的「金标准」,直接关联到患者的生存获益。这种双重终点的设计能够更全面地评价治疗方案的获益,同时在统计学上的要求更高,增加了研究成功的难度。从基线特征来看,EXTENTORCH 研究入组患者与中国 ES-SCLC 患者的流行病学特点高度一致,为中国患者临床治疗提供了极具参考价值的数据。此外,EXTENTORCH 研究采用依托泊苷及铂类(顺铂/卡铂)方案诱导治疗 4~6 个周期,在治疗方案上展现了高度的灵活性和临床适用性。
本次发表在《JAMA Oncology》上的 EXTENTORCH 研究结果显示,特瑞普利单抗联合化疗一线治疗 ES-SCLC 具有显著的疗效优势以及可控的安全性。主要亮点包括:
从近期疗效来看,特瑞普利单抗组盲态独立评审委员会(BICR)评估的客观缓解率(ORR)为83.0%,相较安慰剂组 ORR(73.5%)绝对值提升了近 10%;两组疾病控制率(DCR)分别为 92.4% 和 92.2%。此外,特瑞普利单抗组 BICR 评估的中位缓解持续时间(DoR)为 4.4 个月,优于安慰剂组的 4.2 个月(HR=0.692,95%CI 0.538-0.889,HR=0.0041)。
该研究还根据 PD-L1 表达状态进行了亚组分析,结果发现,在 PD-L1 阳性亚组中,特瑞普利单抗组研究者评估的 ORR 高达 95.0%,远远高于安慰剂组的 62.1%(P=0.0084);在 PD-L1 阴性亚组中,两组 ORR 相似。
从远期疗效来看,EXTENTORCH 研究获得了双主要终点阳性,使特瑞普利单抗成为全球首个在 ES-SCLC 一线治疗Ⅲ期临床研究中取得 PFS、OS 双主要研究终点阳性的 PD-1 抑制剂。
特瑞普利单抗组研究者评估的中位 PFS 达 5.8 个月,与安慰剂组相比,显著降低疾病进展或死亡风险 33%(HR=0.67;95%CI 0.54-0.82;P<0.001);特瑞普利单抗组的 1 年 PFS 率达18.1%,是安慰剂组的近 4 倍。所有关键亚组均观察到了一致的 PFS 获益;PD-L1 阳性和 PD-L1 阴性的患者之间的PFS HR值也未观察到差异(HR 分别为 0.69 和 0.71)。此外,特瑞普利单抗组 BICR 评估的 PFS 也显示出了一致的改善。
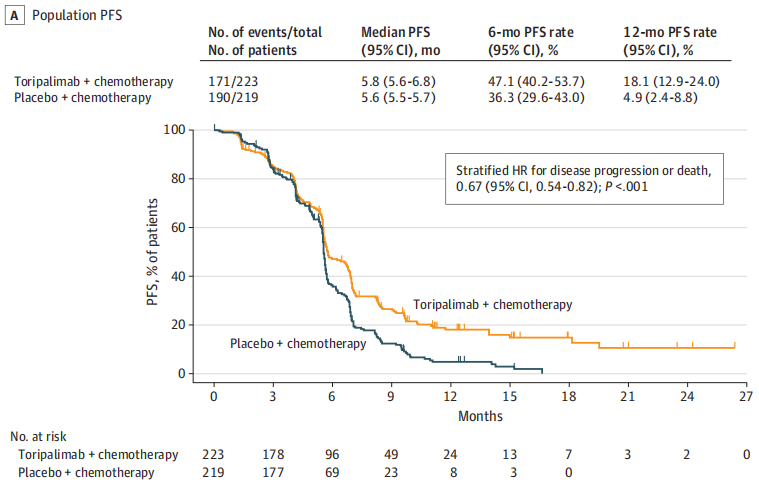
值得注意的是,尽管安慰剂组有更多的患者在完成研究治疗后继续接受 ≥ 3 线治疗(59.4% vs 39.5%),且后续接受 PD-(L)1 抑制剂(25.1% vs 13.9%)和酪氨酸激酶抑制剂(44.3% vs 33.6%)治疗的患者比例更高,但特瑞普利单抗组 OS 依然获得了显著改善,中位 OS 达 14.6 个月(vs 安慰剂组 13.3 个月),降低死亡风险 20%(HR=0.80;95%CI 0.65-0.98;P=0.03);1 年 OS 率(63.1% vs 54.9%)更高。所有关键亚组均观察到了一致的 OS 获益;在 PD-L1 表达阳性和阴性患者中,OS HR 也显示出相似的获益趋势(HR 分别为 0.62 和 0.92)。

图 3:EXTENTORCH 研究 ITT 人群 OS 结果
而且,对 OS 的敏感性分析发现,校正后续抗肿瘤治疗影响后,特瑞普利单抗组 OS 改善更加显著。排除后续接受 PD-(L)1 抑制剂的患者后,特瑞普利单抗组相比安慰剂组中位 OS 延长 3.1 个月(14.6 个月 vs 11.5 个月),降低死亡风险 31.1%(HR=0.689)。

安全性数据显示,特瑞普利单抗和安慰剂组任何级别治疗期间出现的不良事件(TEAEs)(99.5% vs 100%)和 ≥3 级TEAE(89.6% vs 89.4%)发生率均相似。两组最常见的 TEAEs 包括中性粒细胞计数减少、白细胞计数减少、贫血、血小板计数减少、恶心、食欲减退、呕吐等。整体而言,特瑞普利单抗联合化疗具有良好的耐受性和可控的安全性,随访期间未出现新的安全性信号,为患者长期用药提供了保障。
您如何看待特瑞普利单抗在 ES-SCLC 领域的应用前景?未来 SCLC 领域还有哪些值得探索的方向?
邬麟 教授
湖南省肿瘤医院
ES-SCLC 患者的预后往往较差,5 年生存率只有不到 7%[4]。过去 30 年来,依托泊苷联合铂类(EP 方案)一直是 ES-SCLC 患者一线治疗的标准疗法,但该治疗方案的中位总生存期仅为 10 个月左右[5,6],未能满足患者的临床治疗需求。EXTENTORCH 研究证实了特瑞普利单抗的强效抗肿瘤活性、显著的 PFS 和 OS 获益以及可控的安全性,为 ES-SCLC 一线治疗带来了新选择。
随着 SCLC 全面开启免疫治疗时代,如何优化免疫联合治疗模式,进一步提升患者的获益,已成为临床上关注的话题。针对 ES-SCLC,目前全球研究者已经开展了诸多探索,包括 PD-(L)1 抑制剂联合新型免疫治疗药物(如 TIGIT 抑制剂、LAG-3 抑制剂)、免疫联合化疗和小分子抗血管生成药物、免疫联合靶向治疗、免疫联合胸部巩固放疗等。其中,特瑞普利单抗联合 BTLA 单抗 Tifcemalimab 用于难治性 ES-SCLC 已在 I/II 期临床研究(NCT05000684)中展现出了令人鼓舞的抗肿瘤活性和可管理的安全性[7],在2024 年世界肺癌大会(WCLC)上公布的最新结果显示,该免疫联合方案治疗的 ORR 为32.6%,DCR 为 51.2%,DoR 为 5.7 个月,中位 PFS 为 2.8 个月,中位 OS 为 12.3 个月[8]。
针对局限期小细胞肺癌(LS-SCLC),目前免疫治疗的探索主要包括两种模式,即放化疗联合免疫治疗和放化疗后免疫巩固治疗,均展现出了广阔的应用前景。特瑞普利单抗在 LS-SCLC 中同样有所布局。目前,全球多中心 III 期 JUSTAR-001 研究(NCT06095583)正在开展中,旨在评估特瑞普利单抗 ± Tifcemalimab(抗BTLA单抗) 作为 LS-SCLC放化疗后未进展患者巩固治疗的疗效与安全性。未来期待免疫联合治疗在 SCLC 领域的持续探索能够为患者带来更显著的疗效突破。
多维度探寻免疫治疗的疗效预测生物标志物,以精准识别潜在获益人群,同样是 SCLC 领域的重要探索方向。
既往有研究显示,PD-L1 和肿瘤突变负荷(TMB)不能作为 SCLC 免疫治疗的生物标志物,这也在 EXTENTORCH 研究中得到了验证。EXTENTORCH 研究中,研究人员对来自 300 例患者肿瘤活检标本及匹配的外周血单个核细胞(PBMCs)进行了全外显子组测序,结果发现瑞普利单抗治疗的 PFS 和 OS 获益与肿瘤 PD-L1表达水平和 TMB 状态无关[2]。

图 4:TMB 与免疫治疗 PFS 和 OS 获益无关
此外,分子分型、免疫微环境也是 SCLC 疗效预测生物标志物的重要探索方向。EXTENTORCH 研究发现, KMT2D、COL4A4、CTNNA2 和 SCN4A 序列变异与 PFS 和 OS 结果具有显著的交互作用,其中 KMT2D、COL4A4 野生型和CTNNA2、SCN4A 序列变异患者接受特瑞普利单抗治疗的 PFS 和 OS 更佳。
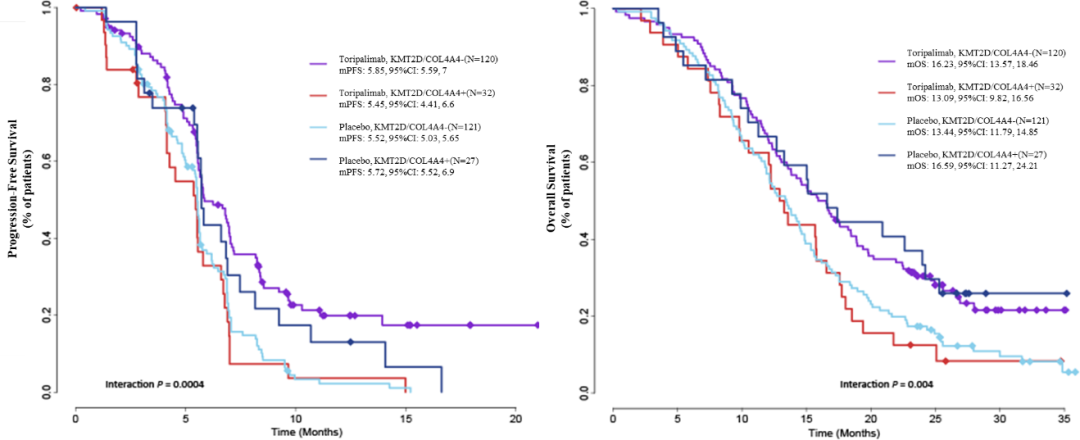

图 5:KMT2D/COL4A4(上)和 CTNNA2/SCN4A(下)序列变异与两组生存结果具有显著交互作用
基因集富集分析(GSEA)则发现,黏着斑/整合素途径突变患者接受免疫联合治疗的生存获益较少。而肿瘤内异质性(ITH)低的患者[定义为等位基因突变的肿瘤异质性(MATH)评分 < 29]以及 HLA-A11+ HLA-B62- 单倍型患者接受免疫治疗的 PFS 和 OS 获益更大[2]。

图 6:黏着斑/整合素途径突变与两组生存结果具有显著交互作用

图 7:ITH 低(上)和 HLA-A11+ HLA-B62- 单倍型(下)患者免疫治疗生存获益更大
这些发现为筛选免疫治疗优势人群有望提供新的启发和视角。期待随着未来研究的不断深入,能够进一步揭示 SCLC 治疗中的关键生物标志物,从而推动 SCLC 治疗更加精准化。
总而言之,凭借 EXTENTORCH 研究的突破性成果,特瑞普利单抗已成为我国 ES-SCLC 患者一线治疗的重要优选方案,为众多患者带来了新的生机与希望。展望未来,期待免疫治疗在 SCLC 领域不断取得新的突破,从而使更多的患者受益,实现长期生存。
- 邬麟 教授 -
主任医师,博士生导师、博士后合作导师
湖南省肿瘤医院(中南大学湘雅医学院附属肿瘤医院)胸部内二科主任,内科教研室主任
湖南省肺癌临床研究中心主任
中国抗癌协会老年肿瘤专委会副主委
中国医促会肿瘤舒缓治疗学分会副主委
中国南方肿瘤临床研究协会(CSWOG)常务理事
CSWOG 肺癌专业委员会副主任委员兼秘书长
中国老年保健协会肺癌专业委员会副主委
中华医学会肿瘤学分会肿瘤内科专委会委员
中国临床肿瘤学会(CSCO)理事
中国抗癌协会临床化疗专业委员会常委
中国抗癌协会原发灶不明及多原发癌专委会常委
CSCO 罕见肿瘤专家委员会常委、老年肿瘤专委会常委
湖南省健康服务业协会肿瘤防治分会理事长
湖南省抗癌协会肿瘤化疗专业委员会主任委员
湖南省医师协会肿瘤医师分会副会长
湖南省抗癌协会肺癌专业委员会副主委
湖南省抗癌协会分子靶向治疗专业委员会副主委
湖南省抗癌协会肿瘤精准医学专业委员会候任主委
Gaspar LE, et al. Clin Lung Cancer. 2012;13(2):115-22. Y. Cheng, et al. JAMA Oncol. 2024. Y. Cheng, et al. 2023 ESMO. Abstract LBA93. Megyesfalvi Z, et al. CA Cancer J Clin. 2023;73(6):620-652. Socinski MA, et al. J Clin Oncol. 2009;27(28): 4787-4792. Rossi A, et al. J Clin Oncol. 2012;30(14):1692-1698. Y. Cheng, et al. 2023 ASCO. Abstract 8579 Y. Cheng, et al. 2024 WCLC. Abstract MA17.08.


声明
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论