
关键词
PROTAC,降解剂
Linker,E3泛素链接酶
一、PROTAC技术介绍
Craig M. Crews和Raymond J. Deshaies教授于2001年共同实现了PROTAC分子降解靶蛋白的技术,该技术利用人体内天然存在的泛素-蛋白酶体系统(Ubiquitin-Protease System,UPS)发挥作用,UPS系统的正常生理功能是负责清除细胞中变性、突变或有害蛋白质【1】。
 图1.PROTAC技术示意图【1】
图1.PROTAC技术示意图【1】
PROTACs(PROTAC small molecule)作为一个双功能小分子,一端靶向目标蛋白,另一端与体内的E3泛素连接酶结合,在细胞内形成一个稳定的三元复合物,进而通过UPS泛素化并降解目标靶蛋白,同时释放出PROTACs,实现催化循环过程(图1)。PROTACs与小分子抑制剂相比具有克服耐药,减少毒副作用,弱的结合力也可以发挥作用,靶向不可成药靶点等优势【2】。
自2001年首次提出,经过二十多年的发展,基于PROTAC技术目前已经有四十种药物进入临床。从总体看可以分为两个阶段:“构建阶段”以及“转化阶段”(图2)。2001年至2007年,报道的PROTACs为多肽类化合物,较差的透膜性导致降解效率只有微摩尔级别。2008年,Crews教授报道了第一个小分子类的PROTACs【3】。2013年,有研究报道了第一个多肽类PhosphoPROTACs,首次探究了PROTACs体内抗肿瘤作用,与对照组相比可达到40%的肿瘤抑制率【4】。2015年,Crews课题组报道了靶向ERRα的小分子类型PROTACs,100 mg/kg每天腹腔注射三次,与对照组相比,肿瘤内的ERRα水平降低39%【5】。2019年,Arvinas公司将两种PROTACs:靶向AR的降解剂ARV-110以及靶向ER的降解剂ARV-471推向临床,开启了PROTACs的“转化阶段”。目前,ARV-471已经进入临床III阶段。
 图2.PROTACs发展历程
图2.PROTACs发展历程
PROTACs主要由3部分组成,POI Ligand,E3泛素连接酶配体以及中间的Linker。POI Ligand主要由和靶蛋白具有结合力的小分子配体,多肽以及核酸等组成。由于小分子抑制剂具有稳定的理化性质,生物利用度高,且上市或者处于前期研究阶段的小分子均可作为目标蛋白配体等优势,目前广泛用于构建PROTAC分子库。据PROTACs数据库报道,目前超过一百种蛋白质可被降解,涉及各类激酶、核受体、溴结构域以及跨膜蛋白等【6,7】。据统计,80%以上降解靶点为癌症相关蛋白,通过降解ATP口袋结合蛋白、转录调节相关蛋白、凋亡以及细胞周期蛋白等发挥作用【8】(图3)。
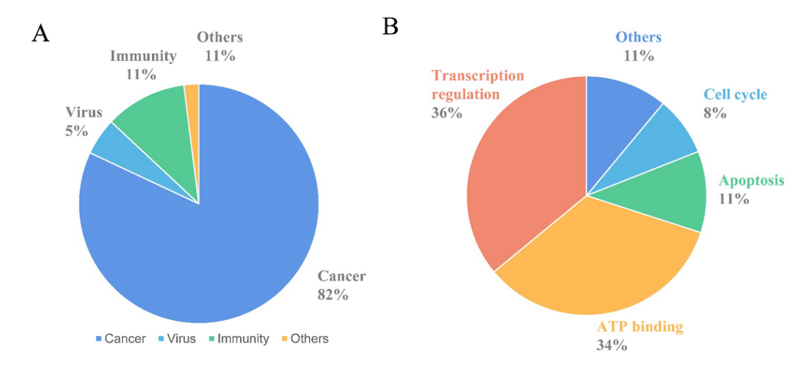 图3.已报道的PROTACs分布比例【8】
图3.已报道的PROTACs分布比例【8】
目前,人体内共发现有600多种E3泛素连接酶,但实际用于招募E3泛素连接酶的配体小分子却十分有限。常用的有CRBN配体,以沙利度胺及其衍生物为主,VHL配体以VH032及其衍生物为主【9】(图4)。但招募CRBN以及VHL的配体仍然是PROTACs设计中最常用的E3泛素连接酶配体,占总体PROTACs的90%以上。两者主要有以下几个有利特征:首先,两者与靶向的E3泛素连接酶具有较好的亲和力;其次,适中的理化性质,如分子量、溶解度、相对较好的稳定性等;最后是两者的小分子配体与E3泛素连接酶结合模式已被披露。

图4.常用的E3配体
Linker:以烷基链、乙二醇(PEG)、炔基、三氮唑、哌嗪为主的连接片段被广泛应用于PROTACs的设计,连接片段的长度、组成、亲水疏水以及刚性程度对三元复合物的形成及其稳定性有着重要影响,直接影响其降解活性以及靶蛋白的特异性【10,11】(图5)。目前,没有一种连接片段可以对任何配体都有效果,因此针对不同的靶点都需要系统合理的设计筛选。
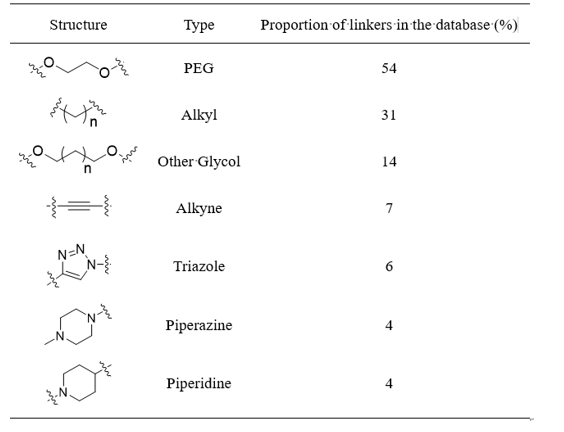
图5.文献中报道的Linker占比【10】
二、PROTAC在研药物信息
目前PROTAC暂无上市药物,在临床III期1个,II期2个,临床I/II期8个,临床I期23个(图6)。靶点主要集中在雄激素受体(AR)和酪氨酸蛋白激酶(BTK)两个靶点。主要适应症为前列腺癌、乳腺癌、实体瘤、痤疮、皮炎等。主要研究机构包括Arvinas、Kymera、C4 Therapeutics、冰洲石生物科技(上海)有限公司、海思科等。

图6.PROTACs上市情况统计表
(来源:智慧芽)
三、PROTAC公司介绍
【Arvinas】
Arvinas公司,由耶鲁大学的Craig M. Crews教授创办,于2013年2月成立,2019年将两款PROTACs首次推向临床(ARV-471以及ARV-110);2021年,与辉瑞达成战略合作,共同开发Vepdegestrant(ARV-471),并于2022年将其推入临床III期研究(图7)。
Arvinas公司建立了专有技术平台(PROTAC Discovery Engine)合理设计PROTACs,并取得多个重大突破:首次将可口服的PROTAC分子推入临床;首次验证降解剂在人体内的安全性、有效性;首次报道临床前穿过血脑屏障的降解剂。
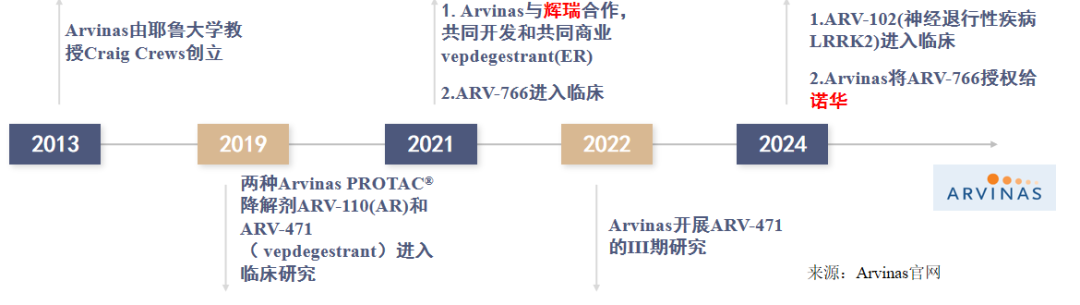 图7. Arvinas公司发展历程
图7. Arvinas公司发展历程
(来源:Arvinas官网)
Arvinas公司利用PROTAC Discovery Engine平台快速筛选苗头分子,并将苗头化合物优化后推进至临床。该技术平台可分为3部分:首先利用Arvinas公司的E3知识库以及先进的筛选技术,识别并筛选出E3连接酶配体以及靶标配体;其次利用计算建模以及独特的Linker库以及最先进的蛋白质组学快速设计PROTAC分子;最后通过“Arvinas 规则”优化体内PK/PD以及药物疗效(图8)。基于该技术平台,Arvinas已将4款药物推入临床阶段。
 图8. Arvinas公司研发平台
图8. Arvinas公司研发平台
(来源:Arvinas官网)
【Kymera Therapeutics】
Nello Mainolfi博士是Kymera Therapeutics的创始人、总裁兼首席执行官(曾就职于诺华)。公司成立于2015年,建立了一个由多个临床阶段、跨各种适应症的同类首创降解剂项目组成的管道,其开发了一流的药物发现平台并筹集了超过10亿美元的资金,并与赛诺菲、GSK、Vertex Pharmaceuticals等建立了战略合作关系。
Kymera公司专注于传统药物无法解决的重大需求的领域,侧重于免疫学以及肿瘤学领域。该公司技术平台利用高通量筛选(DEL库以及基于片段和 X 射线的筛选)、人工智能优化技术确定苗头化合物以及进行先导化合物的优化。此外,公司还利用全球定量蛋白质组学技术将靶蛋白与公司文库中的最佳E3连接酶相匹配,提高PROTACs降解能力以及选择性。最后基于构建的药物预测模型,优化降解剂在不同组织和细胞类型中的体外/体内药代动力学/药效学关系(图9)。
 图9. Kymera公司研发平台
图9. Kymera公司研发平台
(来源:Kymera官网)
Kymera公司目前有3款药物进入临床,其中IRAK4靶点的KT-474药物目前处于临床II期阶段。2020年7月,Kymera公司与赛诺菲达成多项计划的战略合作,获得1.5亿美元的预付款,共同开发KT-474(图10)。
 图10. Kymera公司研发管线
图10. Kymera公司研发管线
(来源:Kymera官网)
四、总结与展望
2018至2021年全球PROTAC融资额超过40亿美元,合作投入超过125亿美元,四十多个PROTAC分子进入临床,临床结果反馈积极。但PROTAC分子的开发还存在一些方面的问题:①生物利用度:分子量大,溶解性较差,体内外渗透性表现不佳,口服生物利用度通常偏低,优化难度高。②给药剂量问题:在高浓度时会观察到钩子效应,导致药效降低或出现毒性反应。③毒理学问题:存在潜在的靶向和非靶向副作用。但整体看,PROTAC技术正处于蓬勃发展阶段,另外溶酶体靶向嵌合体(LYTACs)、自噬靶向嵌合体(AUTACs)等新兴的降解技术也陆续报道出来。
References
1.Zou Y, Ma D, Wang Y. The PROTAC technology in drug development. Cell Biochem Funct. 2019 Jan;37(1):21-30.
2.Jin J, Wu Y, Chen J, Shen Y, Zhang L, Zhang H, Chen L, Yuan H, Chen H, Zhang W, Luan X. The peptide PROTAC modality: a novel strategy for targeted protein ubiquitination. Theranostics. 2.2020 Aug 8;10(22):10141-10153.
3.Schneekloth A R, Pucheault M, Tae H S, et al. Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics [J]. Bioorg Med Chem Lett, 2008, 18(22): 5904-8.
4.Hines J, Gough J D, Corson T W, et al. Posttranslational protein knockdown coupled to receptor tyrosine kinase activation with phosphoPROTACs [J]. Proc Natl Acad Sci U S A, 2013, 110(22): 8942-7.
5.Bondeson D P, Mares A, Smith I E, et al. Catalytic in vivo protein knockdown by small-molecule PROTACs [J]. Nat Chem Biol, 2015, 11(8): 611-7.
6.Li R, Liu M, Yang Z, et al. Proteolysis-Targeting Chimeras (PROTACs) in Cancer Therapy: Present and Future [J]. Molecules, 2022, 27(24).
7. Weng G, Cai X, Cao D, et al. PROTAC-DB 2.0: an updated database of PROTACs [J]. Nucleic Acids Res, 2022.
8.Sun X, Gao H, Yang Y, et al. PROTACs: great opportunities for academia and industry [J]. Signal Transduct Target Ther, 2019, 4: 64.
9.Ishida T, Ciulli A. E3 Ligase Ligands for PROTACs: How They Were Found and How to Discover New Ones [J]. SLAS Discov, 2021, 26(4): 484-502.
10. Troup R I, Fallan C, Baud M G J. Current strategies for the design of PROTAC linkers: a critical review [J]. Explor Target Antitumor Ther, 2020, 1(5): 273-312.
11.Anwar Z, Ali M S, Galvano A, et al. PROTACs: The Future of Leukemia Therapeutics [J]. Front Cell Dev Biol, 2022, 10: 851087.

成都诺和晟泰生物科技有限公司是一家以多肽药及小分子化药为主,集药品研发、技术服务及技术转让为一体的综合型CRO服务企业。传承集团公司北京阳光诺和药物研究股份有限公司(股票代码:688621)的业务模式,诺和晟泰形成“全创新链+全产业链”的核心竞争体系,通过资源整合,实现了高质、高效、高度专业化的技术服务,助力医药企业的创新发展。为了顺应医药市场的需求,公司以自主创新谋发展,实施“最具效率全链条CRO服务+最具市场价值创新药物开发”双引擎驱动发展战略。现已为100余家省内外知名医药企业提供专业技术服务,有望成为全国领先的CRO企业,为国内外客户提供“创新、识卓、业专、效捷”的研发服务。
END





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论