今年5月,安徽医科大学第一附属医院和云南农业大学合作,成功将经过基因改造的猪肝脏移植到了一位肝癌重症患者身上。
术后第七天,患者已能下地自由活动,没有发现超急性和急性排斥反应,凝血系统无障碍,肝功能已恢复正常。移植猪肝方面,每天有200ml左右金黄色胆汁分泌,CT和B超证实移植猪肝脏肝动脉、门静脉、肝静脉血流完全正常。
这是全球第五起活体异种器官移植,仅2024年便发生了其中的三起。
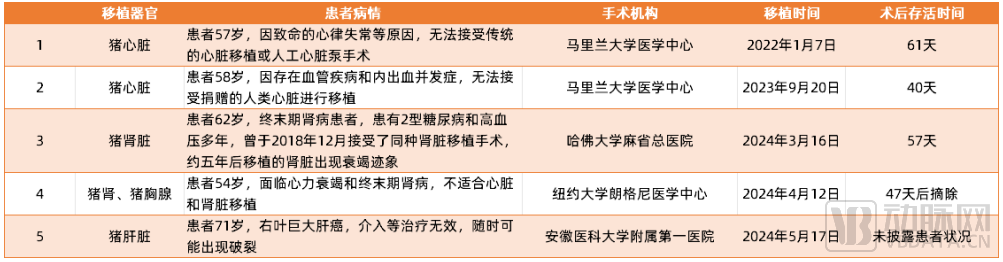
2022—2024年发生的5起活体异体器官移植
活体实验外,死亡人体相关的移植试验也在加速进行。今年3月,空军军医大学西京医院团队将多基因编辑猪的全肝与肾脏分别移植到了两位脑死亡人体内,术后均在一定时间内实现正常运转。昆明医科大学第一附属医院同样找到了云南农业大学,开展了一起从猪到脑死亡人体的肝肾联合异种移植实验,同样取得了不错的进展。
爆发的临床试验之下,器官移植似乎已经走到了技术迁跃的边缘。
广义上的器官移植不局限于动物到人体的移植,还包括技术已经相对成熟的人到人体,即将有活力的供体器官通过手术转移至患者体内,以替代已经丧失功能的器官。
目前,我们的大部分器官已能实现移植,如心脏、肺、肝、肾脏、胰、小肠、皮肤等。此外,角膜和血管等组织的移植也已在临床中广泛应用。
不过,当下的器官移植产业远谈不上成熟。以最为常见的“换肾”为例,当双侧肾脏功能均丧失时,或是慢性肾功能不全发展至终末期,肾脏移植都是可行情况下的首选治疗方案。此外,相比腹膜、血液透析,肾移植在长期存活率、生存质量和治疗成本等方面均有明显优势。
但由于肾移植主要是通过配型的方法来进行,匮乏的肾源与不成功的配型下,很多患者直到病逝也未能等到治疗机会。
参考国际器官捐献与移植注册数据,2020年底有超过34.54万名患者仍在等待器官移植,仅在公布数据的那一年,等候名单中便有23103名患者,因未等到肾源遗憾去世。
还有一组数据能够更为直接地阐述现状:全球有逾266万名接受透析治疗的终末期肾病患者,仅有5.65%患者能够获得肾脏移植。
应对这一挑战,全球各地都在推动产业相关法律法规的完善,建立更加透明、公正的器官捐献移植体系,通过理顺关系、明晰法律、加速传播等树立公众对于器官移植的正常认知,进而鼓励更多人群参与到器官的传递中。
譬如,西班牙、法国等每百万人口器官捐献率排名靠前的国家推行的是“默认同意”,即生前未明确表示拒绝捐献者均被推定为器官捐献者;美国大部分州采用了领取驾照时登记捐献器官意愿的制度。
而在国内,国务院发布的《人体器官捐献和移植条例》于今年5月1日正式施行,进一步对于器官移植行业进行规范。相比2007年施行的《人体器官移植条例》,新条例增加“捐献”二字,凸显器官捐献的重要性,强化了对器官捐献的激励与引导。
与此同时,器官移植产业也在不断进化,尽可能提高离体器官的存活率。
目前,主流的肝脏保存、转运的机械灌注分为常温灌注与低温灌注两种技术路径,可服务于不同的供体和治疗场景。
肝脏常温机械灌注(NMP)的灌注温度维持在35-38℃,器官处于生理代谢状态,耗氧量大,灌注需使用氧合的血液制品。优势在于可以通过胆汁生成和乳酸清除率来评估肝脏质量,作为平台未来有治疗递送的应用空间;缺点在于短暂灌注中止也会造成肝脏二次缺血、血制品相关风险、操作复杂、灌注成本高。
肝脏低温机械灌注(HMP)的灌注温度维持在0-12℃,低温状态下肝脏代谢受抑制。优势在于低温下肝脏对缺血的耐受度更高,缺血造成的术后胆道并发症率降低,且短暂的技术故障不会导致器官热缺血损伤、造成功能丢失;缺点在于低温下肝脏功能评估指标较NMP少。
在全球已实现商业化的肝脏机械灌注设备中,Transmedics与OrganOx两家企业均应用NMP技术,XVIVO则采用可调温灌注系统。国内的健耕医疗、奇点医疗、莱普晟的机械灌注均采用HMP技术。
其中,健耕医疗的 LifePort肾脏灌注运转箱被近 40 个国家和地区、数百家 OPO 或移植中心使用。美国 57 家 OPO 中的 54 家使用 LifePort的产品进行供肾机械灌注,市场占有率第一。
 健耕医疗LifePort产品体系
健耕医疗LifePort产品体系
奇点医疗则是与中山一院实现深度合作,推出了“无缺血肝脏灌注系统”,实现为离体器官供血供氧,在不中断血流情况下维持肝脏正常生理功能,颠覆了传统器官冰鲜保存方式,极大程度上避免了供体器官缺血再灌注损伤,显著改善移植预后,将器官移植推向了“热移植时代”。
此外,该企业还将技术突破直指肾源,推出“器官拯救者”设备。该设备可利用既往手段无法实施捐献的器官——心死亡器官捐献,有望增加50%以上的器官来源,缓解器官短缺问题。
尽管围绕离体器官存活率展开的各种创新有效提高了移植患者的五年生存率,亦在一定程度上扩展了可用活体器官的供应量。但要补足移植患者庞大的需求缺口,异种器官移植才是解决问题的根本之道。
在非人灵长类动物模型的临床前研究中,肾脏和心脏被认为是最适合进行异种移植的器官。经CRISPR修饰该猪的基因组以敲除抗原编码基因,并加入人类基因并清除猪病毒,该猪肾在试验猴体内最终存活了758天。
心脏方面,原位移植(移除受体心脏)的最长存活时间为264天,异位心脏移植(不移除受体本身的心脏)的最长存活时间纪录则达到了近1000天。
不过,无论是上述提到的5例活体异种器官移植手术中,还是人体到人体完成的移植器官,患者的术后生存率都还不尽如人意。
除去尚未披露治疗结果的安徽医科大学第一附属医院完成的异种肝移植手术,其余活体异种器官移植手术的患者最长存活时间仅为61天。USRDS 2021年度报告中阐述的同种移植手术数据显示,公民逝世后器官捐献/活体捐献的肾移植后十年生存率为49.5%/65.5%,同样存在极大的提升空间。
感染是肾移植术后早期死亡最常见的原因,与术后免疫抑制过度、营养不良及术后并发症等有关。以免疫抑制过度为例,对于已经完成肾移植的患者,免疫抑制不足可能导致排斥反应,造成移植物结构损伤、移植物功能丢失、再移植困难;免疫抑制过度又会增加发生感染和肿瘤的风险。
此外,常用的免疫抑制剂(如环孢素、他克莫司、咪唑立宾等)治疗效果稳定,但有不良反应多,治疗方案局限等缺点。此外,生物免疫抑制剂价格昂贵,巨大的药物治疗费用也在一定程度上阻碍了手术患者的康复进展。
因此,长期、持续地关怀与照护对于此类患者非常重要,医生需要对于患者的免疫状态、移植器官状态进行持续监测和调整,尽早发现问题并干预处理。另一方面,行业也需积极探索新型免疫抑制剂,在疗效与卫生经济学方面找到新的平衡点。
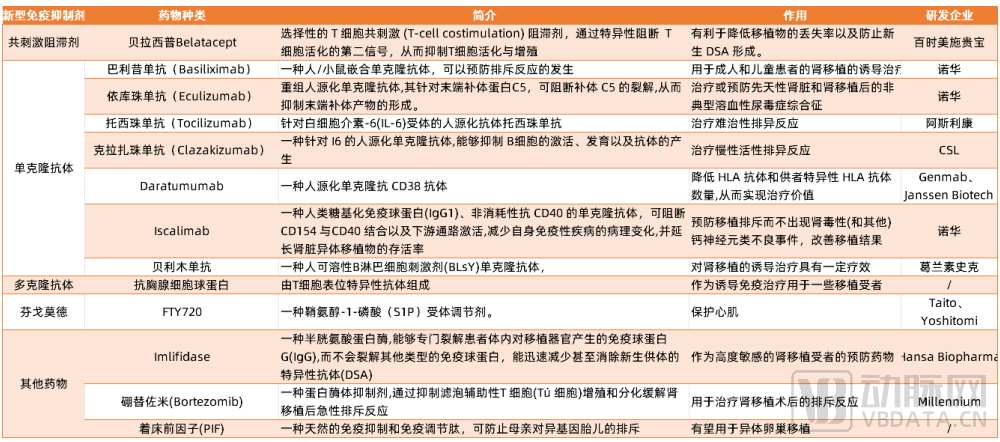 潜在的新型免疫抑制剂盘点
潜在的新型免疫抑制剂盘点
相较之下,异种移植排斥反应相关的基因约有30个,排斥反应更为复杂、更难克服,同时由于免疫抑制措施比同种移植更强,反过来对人体免疫系统的影响也更大,更容易导致固有免疫系统被破坏而发生感染,可能会引发严重并发症。
在全球头两例异种器官移植案例中,Revivicor公司对供体猪实施了10项基因编辑操作,剔除了三个会引发人类快速抗体介导排斥反应的基因,还将六个与人类心脏免疫排斥相关的基因——CD46、CD55、血栓调节蛋白、内皮细胞蛋白C受体、CD47和血红素加氧酶-1(HO-1)植入猪的基因组中,尽可能降低排斥反应的发生概率。
基因编辑大牛George Church创立的eGenesis为全球第三例活人异种移植手术培育了转基因猪。这些猪经过了69项基因组编辑,敲除与猪细胞表面糖抗原合成相关的3个基因,转入7个与排斥反应调节相关的人类基因,以便帮助猪细胞躲过人体免疫系统的盘查。同时,该公司还灭活了供体猪中的猪内源性逆转录病毒,以降低人类感染的风险。
但从结果来看,各个公司在基因编辑上的努力并未完全解决问题,异种移植排斥反应依然是阻碍异体器官移植的终极难关。
面对这一挑战,新西兰的NZeno,德国的Xtransplant,国内的中科奥格、盖兰德生物等初创企业也在积极入局,进行异种移植供体猪的培养,并已取得了非凡的成果。具体而言,他们以基因编辑技术构建低免疫原性供体猪,开发可供移植的猪红细胞、皮肤、肾脏等组织器官治疗技术,同时拓展基因编辑供体猪在生物材料再生医学的应用,推动中国异体器官移植产业的发展。
作为医学界的三大奇迹之一,器官移植最为完整地实现了人类生命高质量延续的梦想。只是,延续并非现代医学的最终目的,数以万计的研究者、医生、患者参与其中,便是为了让未来经历移植的患者,实现真正意义上的重生。
实现这样一个突破必然会经历无数次的失败,但每一次失败均有其意义所在。正如全球首例猪心脏移植手术患者David Bennett的家人所说:
“我们对每一个创新时刻、每一个疯狂的梦想、每一个不眠之夜心存感激,感谢所有为这项历史性的手术付出努力的人,我们希望这个故事可以成为希望的开始,而不是结束。”
走在器官移植技术迁跃的边缘,我们或许即将见证希望本身。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论