本文转载自公众号:细胞基因疗法
圣裘德儿童研究医院的研究团队在临床观察中发现,接受抗PD-L1免疫疗法治疗的骨髓增生异常综合征(MDS)患者表现出生存期延长的现象。深入探究后,他们观察到在这些患者体内的T细胞中存在ASXL1基因突变。类似地,ASXL1基因的突变与DNMT3A和TET2基因的突变一样,均被认为与造血干细胞的寿命延长相关。鉴于这些基因突变与细胞存活能力之间的联系,研究团队推测,这些基因的变化可能会影响T细胞由未分化状态向完全分化状态转变的过程,并且这种机制可能促进了抗PD-L1治疗的有效性。研究人员对T细胞进行了基因编辑,敲除了上述基因,随后将这些经过修饰的T细胞植入小鼠体内,并使它们暴露于持续性的病毒感染环境中。实验结果显示,当这些特定基因被敲除后,尽管T细胞在长达一年的时间里持续受到刺激并不断分裂,但它们并未出现功能异常的情况。更引人注目的是,这些T细胞展现出了类似于干细胞的状态特征。此外,ASXL1基因的缺失还增强了T细胞对抗肿瘤的能力,使得其在与抗PD-L1疗法联合使用时表现出了更好的疗效。该研究为下一代基于“长寿命”功能性T细胞的免疫疗法的合理设计奠定了基础。相关工作以“Epigenetic regulators of clonal hematopoiesis control CD8 T cell stemness during immunotherapy”为题于近日发表在Science。同期,墨尔本大学Axel Kallies和Carlson Tsui还在Science上撰写了题为“Unwrapping stemness to revive T cells”的文章,表示上述研究定义了一种以前未知的表观遗传调控途径,通过控制T细胞的干性有望为改善抗肿瘤治疗的新策略铺平道路。作者之前的研究曾报道过,CD8-T细胞中DNMT3A的破坏可以防止其衰竭,在PD-L1阻断和CAR T细胞治疗期间保持T细胞的增殖能力和效应潜力。此外,TET2的破坏增加了CAR-T细胞在临床前和临床环境中的耐久性。对基于T细胞的免疫疗法的临床反应相关因素的进一步研究也发现了第三种表观遗传调节因子,该调节因子与ICB后骨髓增生异常综合征(MDS)患者亚群的较长生存期有关。这些人的T细胞中含有额外的性梳样1(ASXL1)突变,这与没有ASXL1突变或仅在髓系室中有ASXL1基因突变的患者形成鲜明对比。这些集体研究表明,操纵表观遗传调节因子DNMT3A、TET2和ASXL1可用于延长T细胞介导的保护的持久性。有鉴于此,作者研究了三种促进克隆造血的常见突变表观遗传调节因子,以确定它们是否影响T细胞的干度和对检查点阻断免疫治疗的反应。(图1)。
为了研究Dnmt3a、Tet2和Asxl1在ICB反应性T细胞群的发育和维持中的作用,研究人员改造了T细胞,使其在每个基因内都含有突变,然后通过将它们过继转移到感染淋巴细胞脉络丛脑膜炎病毒(LCMV)克隆13株的小鼠体内,使其暴露于慢性抗原源。在T细胞耗竭的典型模型中,这些调节因子的破坏使它们在慢性抗原暴露期间能够保持其数量和ICB反应状态>1年。尽管受到刺激并经历了1年的抗原驱动增殖,但这些T细胞没有表现出任何恶性生长的迹象(图2)。
图2 在小鼠和人类癌症免疫治疗期间Asxl1表达与生存相关此外,含有每种突变的T细胞总库中富含大量干细胞样Tcf1+T细胞。命运追踪过继转移实验表明,ASXL1 KO T细胞的Tcf1+亚群既可以自我更新,也可以产生强大的效应器。敲除(KO)T细胞的转录和表观遗传分析表明,Asxl1是多梳群-抑制性去泛素酶(PR-DUB)复合物的调节因子,控制组蛋白2A赖氨酸119的去泛素化,赖氨酸是TPEX细胞向TEX细胞发育过渡的分子检查点。将这一机制见解扩展到肿瘤模型中表明,过继转移的具有Asxl1破坏的T细胞能够抵抗肿瘤微环境诱导的耗竭。此外,过继转移的Asxl1 KO T细胞与抗PD-L1阻断协同作用,从而提高了肿瘤控制率。最后,研究还发现Asxl1对肿瘤特异性T细胞的破坏与MDS患者在接受抗PD-L1治疗后T细胞扩增增加有关(图3)。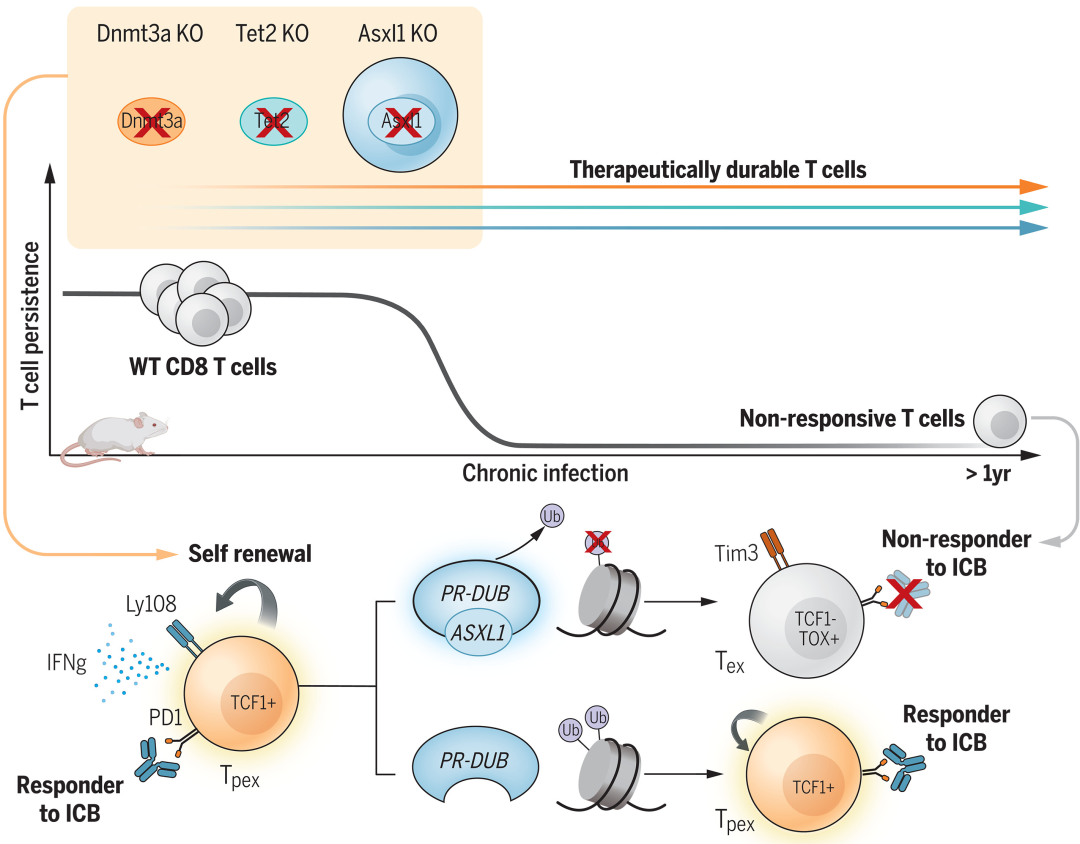
图3 维持治疗持久多能TPEX细胞群体的核心表观遗传调控因子该研究结果表明,DNMT3A、TET2和ASXL1控制着TPEX细胞和终末耗竭T细胞之间的发育检查点。对Asxl1的具体研究揭示了它通过PR-DUB途径的表观遗传修饰在T细胞分化中的作用。通过对与患者生存相关基因的机制研究,该研究为未来工程增强癌症免疫疗法的持久性建立了表观遗传调控因子的特定基因修饰的科学依据。声明:本文旨在知识共享,所有内容仅供参考,不构成任何建议。
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论