
可开发性评估是指对抗体药物候选分子将来成药的可能性进行评估,涵盖治疗候选抗体药物的有效性,安全性和可制造性。抗体可开发性主要评估的四个关键因素包括抗体的特异性、稳定性、溶解性和均一性。其中抗体的非特异性结合和自身相互作用可能会影响抗体药物的特异性、溶解性和稳定性,从而可能损害PK、药效学、生物分布和安全性,是抗体药物在临床前或临床阶段失败的潜在原因。
抗体的非特异性结合是指抗体与目标靶点蛋白以外其他的分子或细胞结合的能力。例如结合肝细胞表面蛋白,血管内皮蛋白,其他可溶性蛋白等。抗体可变区过多的正电荷或极端的疏水性也可能会导致抗体与组织中带负电荷或疏水性的细胞膜和胞外基质(Extracellular matrix,ECM)成分发生低亲和力、非特异性结合。抗体的非特异性结合可降低治疗性抗体的PK、生物分布和有效性。
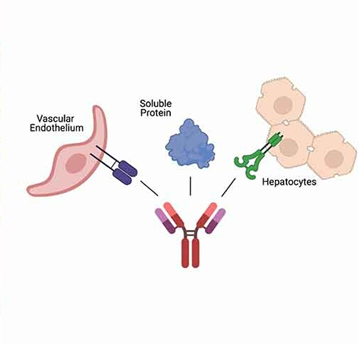
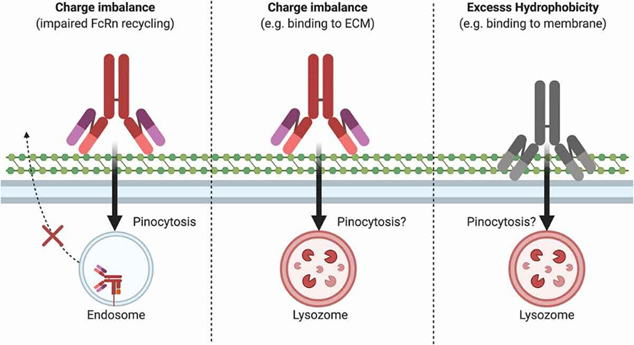
图1 抗体的非特异性结合1
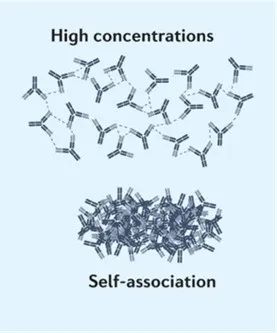
抗体自相互作用是由于静电和疏水相互作用,导致抗体通过自缔合发生聚集。高浓度的抗体会增加聚集倾向。抗体的自相互作用会不仅导致不良的溶解度和粘度特性,还可能对PK、药效、安全性、稳定性产生不利影响以及产生高免疫原性,对抗体开发造成巨大的挑战。
一些已经进入CMC或者临床阶段的抗体药物也会遇到非特异性结合和自身相互作用的问题,导致免疫原性和药物疗效降低等副作用,从而造成巨大的经济损失。例如在临床阶段终止研发的Sirukumab(III期临床)、Dalotuzumab(II期临床)等表现出非特异性结合和高自身相互作用。此外,Jian等人3对137种分别处于获批上市、III期临床和II期临床阶段的抗体进行生物物理特性分析发现,已获批的抗体药物比临床试验中的抗体具有更高的特异性和低自身相互作用。

蓬勃生物多样化解决方案
蓬勃生物可以为客户提供多样化的抗体早期可开发性检测方案,包括非特异性结合检测(BVP ELISA和DNA ELISA)和自身相互作用检测(AC-SINS实验)等,助力客户筛选更具稳定性的候选抗体分子。
▲ BVP ELISA
案例分析:


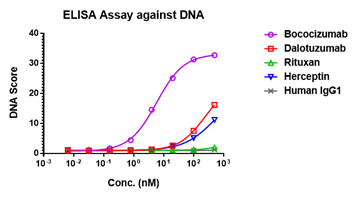
▲ DNA ELISA
案例分析:
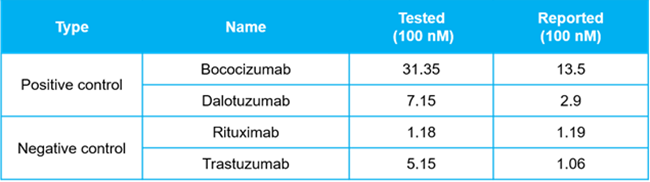
▲ AC-SINS实验

参考文献:
1. Cunningham O, et al. Polyreactivity and polyspecificity in therapeutic antibody development: risk factors for failure in preclinical and clinical development campaigns. MAbs. 2021.
2. Ausserwöger, H., et al. Non-specificity as the sticky problem in therapeutic antibody development. Nat Rev Chem. 2022.
3. Jain T, et al. Biophysical properties of the clinical-stage antibody landscape. Proc Natl Acad Sci U S A. 2017.
4. Starr CG, Tessier PM. Selecting and engineering monoclonal antibodies with drug-like specificity. Curr Opin Biotechnol. 2019.
蓬勃生物(ProBio)拥有一站式生物药研发生产平台,主要致力于为细胞和基因治疗(CGT)药物、疫苗及抗体蛋白药物等提供从靶点开发到商业化生产的端到端CDMO服务。蓬勃生物在美国、荷兰、韩国、上海、香港、南京等地设有公司以服务全球客户。自2017年10月,共助力美国、欧洲、亚太等区域客户获得超过90个IND批件。
蓬勃生物的细胞和基因治疗整体解决方案涵盖了非注册临床、工艺开发,注册临床和商业化全阶段质粒病毒生产。金斯瑞蓬勃生物的生物药开发解决方案涵盖生物药尤其是抗体药发现、抗体工程和抗体评价。在生物药CDMO服务方面,金斯瑞蓬勃生物为客户提供包括细胞系开发、宿主细胞商业化授权、上下游工艺开发、分析方法开发和临床样品及商业化生产等在内的一体化CDMO服务,并提供分批补料和灌流工艺以满足增长的抗体蛋白药的需求。GMP生产车间满足FDA、EMA和NMPA监管要求。
蓬勃生物始终以“合作加速创新”为理念,致力于帮助客户缩短生物药进入临床的时间,显著降低客户的研发成本,加速医药转化,共创健康未来。





关注我们,了解更多




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论