
一.肾脏和AAV简介
作为泌尿系统中最重要的器官,肾脏在血液循环系统中承担着滤过排出代谢物并重吸收水和营养物质的重要责任。肾脏也具有内分泌功能,可生成肾素、促红细胞生成素、激肽等。肾单位是组成肾脏的结构和功能的基本单位,包括肾小体和肾小管。肾小体内有一个肾小球,它由肾动脉分支形成。肾小球外有肾小囊包绕。肾小囊分两层,两层之间有囊腔与肾小管的管腔相通。肾小管汇成集合管,若干集合管汇合成乳头管,尿液由此流入肾小盏。
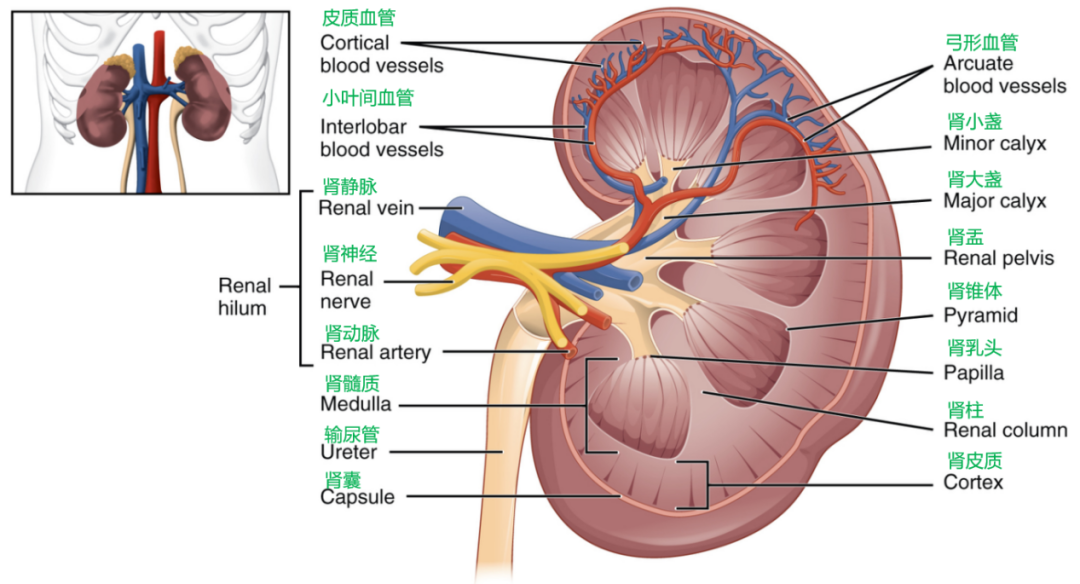
图1. 肾脏结构示意图(来源于网络)
肾脏中有20多种不同的细胞类型,肾小体的主要细胞包括由构成球内毛细血管的内皮细胞、构成肾小囊的上皮细胞、囊壁反折包裹毛细血管形成的足细胞、及连接毛细血管的球内系膜细胞等;肾小管主要由肾小管上皮细胞构成。多种细胞类型和复杂的结构是阻碍肾脏基因治疗的阻碍,因此,有效的基因传导是该器官分子治疗成功的关键。
AAV作为基因递送的重要载体之一,具有高安全性和物种兼容性。针对不同组织和不同细胞选择合适的血清型、特异性启动子和注射方式有效提高AAV的感染效率。
二.血清型和启动子推荐
2.1 血清型选择
根据文献资料和研究实际经验,肾脏研究的AAV血清型主要以AAV9为主
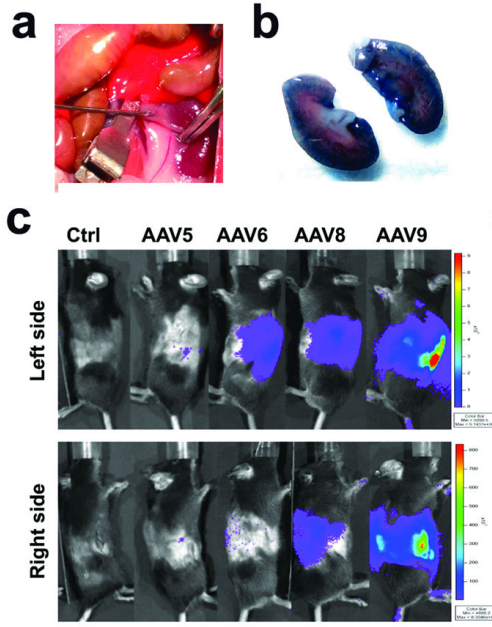
图2.(原文Fig2)肾静脉逆行注射血清型rAAV5、6、8或9的CMV-luc后荧光素酶的表达情况。(a) 肾静脉注射程序的图片。分离左肾静脉,夹紧并使用 31G 针注射 100 μL PBS含有 5×10^10 VG的AAV 。(b) 逆行肾静脉注射台盼蓝溶液后肾脏染色代表图片。(c) 使用IVIS实时成像系统拍摄左肾注射5×10^10 VG的rAAV5、6、8和9的CMV-luc第24周活小鼠左侧(上图)和右侧(下图)的代表性照片。观察到 rAAV6、8 和 9 的左肾区域以及上半身发光。在身体右侧也检测到荧光素酶表达,rAAV8 和 9 也检测到荧光素酶表达。[1]
2.2 启动子推荐
肾脏的研究中,可以使用常规启动子比如过表达使用CMV,干扰等短序列使用U6;此外,还可以选择相应的组织特异性启动子如下表1:
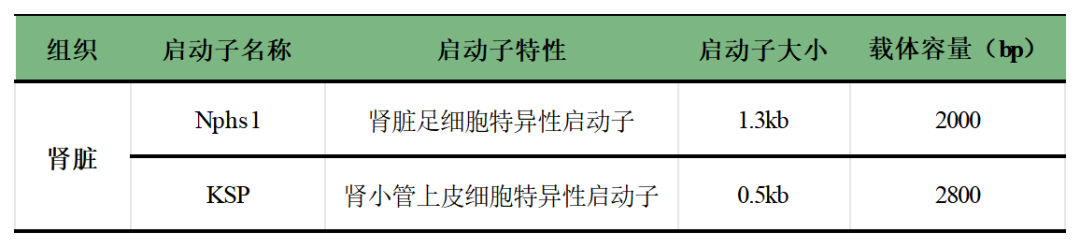
表1. 肾脏常用组织特异性启动子
三.注射方法选择
系统性给药(尾静脉注射)感染肾脏的效果较差,因此研究人员开发了多种肾脏局部注射的方法,包括肾动脉注射、肾静脉逆行注射、输尿管逆行注射、肾实质注射和肾盂注射,总结如下图3和表2。


图3. 肾脏局部注射方法。A.肾动脉注射;B.肾静脉逆行注射;C.输尿管逆行注射 D.肾实质注射:根据针的插入深度,注射进入肾皮质或髓质。
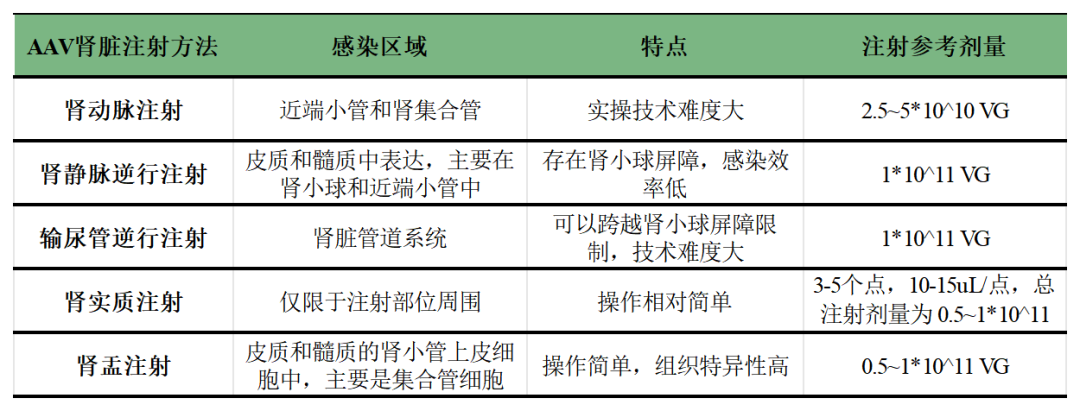
表2. 不同肾脏注射方法的感染范围和病毒剂量汇总
3.1 肾动脉注射
肾动脉注射操作步骤根据文献资料[2],以大鼠为例,体重250-300g,所有动物操作程序均符合规定。具体如下:
1. 术前准备
1) 手术前对所有手术器械进行高压灭菌。如果计划在同一天对不同的大鼠进行多次手术,请在手术后冲洗器械,然后使用玻璃热珠灭菌器进行消毒。
2) 在1 L/min氧气中用4%异氟烷麻醉大鼠。
3) 将大鼠转移到加热垫上,将体温保持在37°C。以1 L/min 氧气流速加以1-2%异氟烷维持麻醉。
4) 皮下注射镇痛药(丁丙诺啡缓释片0.6mg/kg)。
5) 在手术过程中,将药膏涂在眼睛上,以防止干燥。
6) 为了弥补剖腹手术造成的体液流失,术前皮下注射10 ml/kg 0.9%生理盐水非常重要。
7) 刮除腹部毛发,用聚维酮碘和70%乙醇垫清洁皮肤。
2. 手术过程
1) 通过监测身体反射,如脚趾收缩、眼睑反射、下颌张力和呼吸频率模式,确保镇静深度足够。
2) 使用10号手术刀片通过一个小中线切口(长2-2.5厘米)进行剖腹手术。
3) 用棉签将肠和结肠拉到腹部右侧,并用浸有0.9%生理盐水的无菌纱布覆盖,以保持器官湿润。
4) 轻轻向上缩回脾、肝、胃和胰腺,露出主动脉和左肾动脉。
5) 在手术显微镜的帮助下,用钝解剖弯钳和无菌棉签小心地将左肾上下腹主动脉和左肾动脉与静脉、脂肪和周围结缔组织分开。使用镊子沿血管方向反复进行开合运动(钝性解剖)以去除结缔组织,棉签通过横向滚动运动去除脂肪。
注意:主动脉周围区域的解剖是一个非常精细的步骤,因为神经和淋巴管可能会受损。请确保在解剖过程中,用生理盐水保持动脉湿润。
6) 在主动脉下方放置4-0丝线。
7) 使用微血管夹夹住肾动脉分叉处上方(肠系膜上动脉正下方)和下方的主动脉。
8) 用24G静脉导管在左肾动脉分叉处穿刺主动脉,并将导管推进肾动脉。
注意:这是一个关键步骤,因为可能会发生肾动脉戳穿。
9) 将装有药物溶液或生理盐水(最多500μL)的注射器连接到导管上,并灌注肾脏。
10) 灌注后立即用微血管夹夹住左肾静脉和左输尿管,取出导管。然后,将一块可吸收的止血明胶海绵和一小滴组织粘合剂放在主动脉的穿刺区域上,用棉签轻轻施压。
11) 同时,松开左肾动脉分叉处下方腹主动脉的夹子。5分钟后,松开肾静脉和输尿管的夹子。
12) 小心地从左肾动脉分叉处上方的主动脉上松开夹子,让肾脏再灌注。全肾缺血不应超过7分钟。
13) 确保没有活动性出血,并密切观察该区域10分钟以上。
14) 使用4-0可吸收缝合线和连续模式将腹部切口分两层(肌肉和皮肤)缝合,以防止感染。除了连续模式缝合技术外,另一种选择是使用简单的间断缝合技术,特别适用于体壁闭合。
15) 在切口区域涂抹局部抗生素软膏,以防止感染。
16) 将大鼠转移到温垫上的无垫观察笼中,直至完全康复,温度范围设置为35-37°C。应覆盖松散的被褥(例如用盖布或纸巾)或将其从笼中取出,直到动物完全康复。
17) 手术后,连续观察动物,直到其自主呼吸。72小时后,如果观察到不适症状,如嗜睡、驼背等非正常活动,则重新给丁丙诺啡SR等止痛药。
完成所有研究后,对吸入过量二氧化碳的动物实施安乐死,并采集肾组织进行组织学和蛋白质印迹等离体分析。
视频教程:
https://www.jove.com/cn/t/54418/intravascular-delivery-of-biologics-to-the-rat-kidney
3.2 肾静脉逆行注射

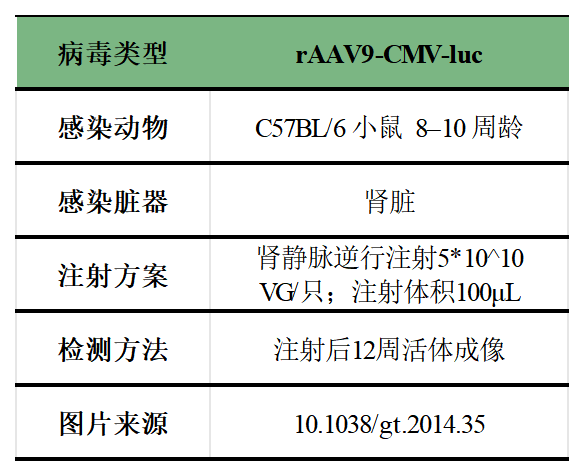
图4. 肾静脉逆行注射案例
肾静脉逆行注射操作步骤根据文献资料[3],以大鼠为例,具体如下:
1) 通过吸入5%异氟醚(混合氧气中)对大鼠进行麻醉,然后将其放置在加热垫上,以保持37°C的核心体温,并使用直肠探头监测体温。
2) 做中线切口以暴露和隔离左肾静脉,并用显微止血夹夹闭肾动脉和静脉以阻止病毒液流出肾脏;(图5)
3) 用30G注射针刺入左肾静脉近端,将100μL AAV(滴度1*10^12 VG/mL)注入肾静脉;
4) 注射约5秒后,拔出针头,用棉签对注射部位施加压力止血。移除血管夹(在动脉夹之前移除静脉夹)以恢复肾脏供血。整个夹持时间不超过3分钟。之后,缝合中线切口,等待动物完全康复。

图5.(原文图1) 肾静脉注射示意图[3]
A. 剖腹手术以暴露左肾之后,夹住肾动脉 (红色) 和静脉 (蓝色),将待递送的AAV病毒注射在夹具和肾脏之间的肾静脉部位。
B. 在流体动力学输送过程中测量肾静脉中的压力。P1,在应用两个血管被夹闭后;P2,流体动力注射;P3,夹具已拆下。
C. 分析方法的示意图,肾脏不同区域的转染效率。
3.3 输尿管逆行注射
输尿管逆行注射操作步骤根据文献资料[4],以小鼠为例,具体如下:
1) 动物准备和剖腹手术。使用无菌(高压灭菌)仪器和耗材执行所有手术操作,腹腔注射盐酸氯胺酮(70mg/kg)和盐酸美托咪啶(1mg/kg)对小鼠进行麻醉。注:产生的麻醉持续时间为4小时,不需要补充麻醉。通过反射丧失(如脚趾夹)确认麻醉深度。去除切口区域周围的所有毛发,并通过涂抹稀释的氯己定溶液为腹部皮肤手术做好准备。将小鼠仰卧放在加热的手术垫上,用低粘性胶带将四肢固定在手术垫上。
2) 皮下注射盐酸丁丙诺啡(0.06mg/kg)进行镇痛,并涂抹眼部润滑剂以防止角膜干燥。
3) 进行中线剖腹手术,暴露左肾,找到输尿管远端和肾动脉并用显微止血夹夹住;
4) 使用消毒过的棉签,通过将肠道移向腹腔右侧来暴露左输尿管,并用湿布覆盖。
5) 使用斜钳分离并提起左输尿管,用 30G注射针扎入输尿管,将注射针贴合于管壁并固定到位,使用 6-0缝线缝合以防液体泄漏;
6) 将小鼠尿液吸出处理干净,用30G注射针将80-100μL AAV(滴度1×10^12 VG/mL)逆行注入输尿管;
7) 将注射针拔出,并在注射部位的近端放置一个显微止血夹以防病毒液渗漏;
8) 5min后,移去输尿管远端、近端及肾动脉上的显微止血夹,用6-0缝线将切口分两层缝合(肌肉和皮肤)。
视频教程:
https://www.jove.com/cn/t/52559/a-murine-model-irreversible-reversible-unilateral-ureteric
3.4 肾实质注射
肾实质注射操作步骤根据文献资料[5],以小鼠为例,具体如下:
1) 采用常规的小鼠麻醉方式,做术前准备,具体可参考前文3.3
2) 对小鼠腹部进行剃毛,消毒,剖腹手术,暴露左肾;
3) 使用26G 1ml Sub-Q注射器经肾囊壁直接向肾实质缓慢注射病毒液,3-5个点,10-15μL/点,总注射剂量为 0.5~1*10^11 VG
4) 腹部切口分两层缝合(肌肉和皮肤),参考前文术后处理方法
3.5 肾盂注射
肾盂注射操作步骤根据文献资料[6],以小鼠为例,具体如下:
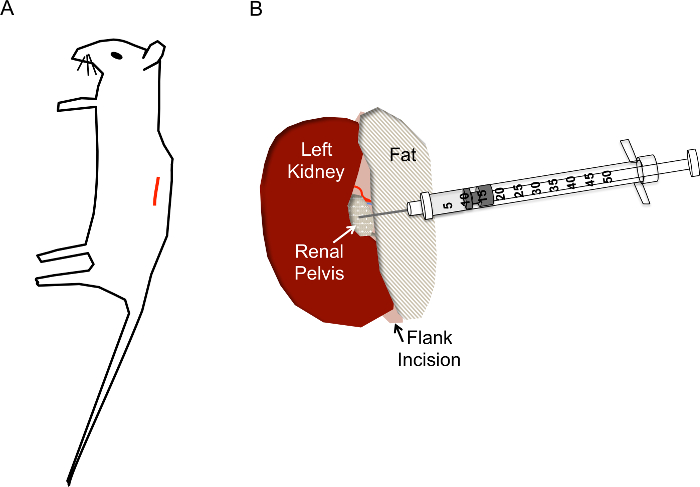
图6. 肾盂注射进针位置示意图
1) 准备手术部位。将无菌盖布放在加热垫上,将无菌手术工具倒在无菌盖布上,不要触摸它们。拿起小鼠并将其放置在视野中,调整照明以照亮该区域。
2) 从包装中取出三根3.15%葡萄糖酸氯己定和70%异丙醇皮肤消毒拭子,放在动物附近。
3) 换上无菌手术手套。从切口部位开始做圆周运动,用新的氯己定/酒精拭子擦拭动物三次。
4) 如图6A所示,确定切口位置。用镊子夹住皮肤,用剪刀在距离脊柱约1厘米处和胸腔下方的皮肤层上剪一个切口,当切口达到1厘米长,继续在肌肉层下方做一个类似的切割。
注意:使切口长度合适,使肾脏勉强通过切口,然后由切口本身保持原位。
5) 找到肾脏。
注意:它可能在白色脂肪组织中可见,脾脏也位于动物的左侧。这些器官的颜色可以通过视觉区分,因为脾脏是深褐红色的,而肾脏是深橙红色的。不要操作脾脏,因为它很容易破裂。
6) 在不接触肾脏的情况下,用手指在腹部施加稳定、温和的压力,轻轻地将肾脏从腹腔中暴露出来(图7C)。如有必要,使用闭合的镊子轻轻地将不需要的器官推回腹部。不要使用开放式镊子,因为这可能会损伤肾脏或其他器官。
7) 一旦肾脏脱离腹部,轻轻地将其与周围的脂肪分开,刚好可以看到肾盂,一个白色的小点(图6B)。如有必要,将多余的脂肪推到一边或去除。一定不要切除位于肾顶极或肾囊附近的肾上腺。
8) 使用闭合的镊子向下推肾脏右侧,使肾盂保持可见,用右手握住装有AAV病毒的注射器,使其与工作面平行,针头指向肾盂(图7E)。如图6B所示,用30G注射针小心地插入肾脏的肾盂中(注意注射针头不应刺穿肾盂),将50μL的 AAV(滴度1×10^12 VG/mL)注入肾盂中。
9) 在3秒内快速完成注射,此时大约三分之一的肾脏可能会变白。
注:注射后,肾包膜内通常会出现液体积聚和血肿形成,但是为达到有效侵染水平,一些损伤是不可避免的。
10) 将针头保持在原位约10秒,以防止病毒液回流。然后小心缓慢地拔出针头。轻轻拉伸切口部位并使用闭合镊子将器官放回腹腔。
11) 用5-0可吸收缝线缝合动物的肌肉层,放置2-4个独立的结。
12) 用5-0或6-0非吸收性尼龙缝合线缝合动物的皮肤层,放置2-4个独立的结。
注意:手术工具可以在放置在无菌珠浴中并冷却后重复使用。

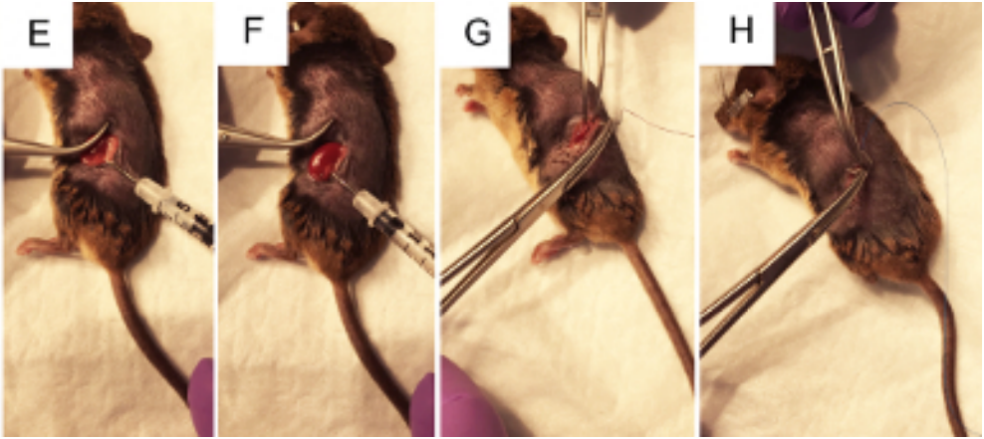
图7. 肾盂注射手术过程示意图
视频教程:
https://www.jove.com/cn/t/56324/hydrodynamic-renal-pelvis-injection-for-non-viral-expression-proteins
本文介绍的几种常见的肾脏感染AAV的注射方法,根据文献和以往经验,AAV9血清型对肾脏的亲和性较高,使用最普遍。另外吉玛基因除了提供常规启动子(CMV、U6等),还可提供肾小管上皮细胞特异性启动子Ksp和肾脏足细胞特异性启动子Nphs1 ,与合适的血清型搭配使用,感染效果更佳。
四.参考文献
[1] Rocca CJ, et al. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Ther. 2014 Jun;21(6):618-28. doi: 10.1038/gt.2014.35.
[2] Franchi F, Zhu XY, Witt TA, Lerman LO, Rodriguez-Porcel M. Intravascular Delivery of Biologics to the Rat Kidney. J Vis Exp. 2016 Sep 1;(115):54418. doi: 10.3791/54418.
[3] Corridon PR, et al. A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors. Am J Physiol Renal Physiol. 2013 May 1;304(9):F1217-29. doi: 10.1152/ajprenal.00070.2013.
[4] EEH, et al. A murine model of irreversible and reversible unilateral ureteric obstruction.[J]. Journal of visualized experiments : JoVE,2014(94).
[5] Jeffrey R,V T N,Kari A, et al.Comparison of Gene Delivery to the Kidney by Adenovirus, Adeno-Associated Virus, and Lentiviral Vectors After Intravenous and Direct Kidney Injections[J]. Human gene therapy,2019,30(12).
[6] ELW, et al. Hydrodynamic Renal Pelvis Injection for Non-viral Expression of Proteins in the Kidney.[J]. Journal of visualized experiments : JoVE,2018(131).

联系我们

苏州吉玛基因股份有限公司
地址:苏州工业园区东平街199号
邮箱:szorder@genepharma.com
电话:0512-86668828
上海吉玛制药技术有限公司
地址:上海浦东新区张江路368号2号楼
邮箱:order@genepharma.com
电话:021-51320195

 赶紧关注我们吧~
赶紧关注我们吧~



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论