
慢病毒的应用场景
目前慢病毒载体主要应用在以下几个方面:
细胞基因治疗(截止目前,已上市的CAR-T产品有9款采用了慢病毒载体递送CAR基因)
基因表达调控(过表达、RNA干扰研究等)
基因编辑(CRlSPR/Cas9 gRNA文库筛选、基因敲除、敲入、点突变、基因激活/抑制)
稳转细胞株构建
活体细胞成像追踪
转基因动物
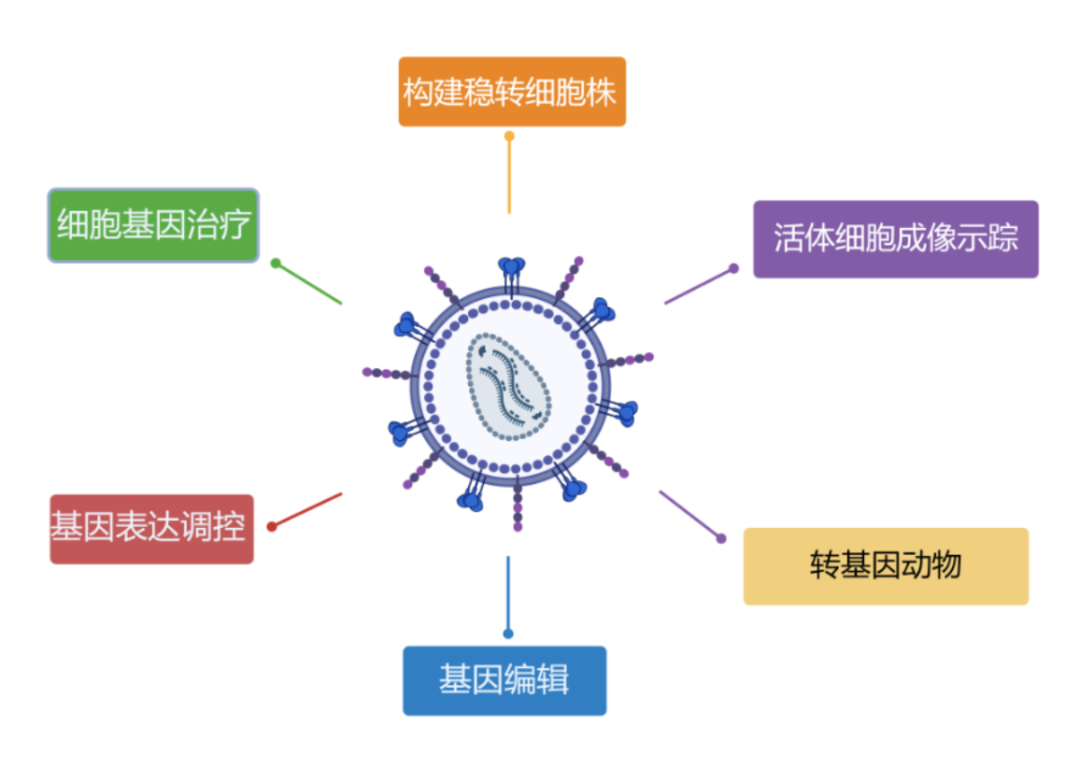
图1 慢病毒载体的主要应用方向
应用案例

实验设计和主要研究结果:
癌症基因组图谱(TCGA)数据库和在线工具评估结果显示ADP依赖型葡萄糖激酶(ADPGK)是唯一一种在前列腺腺癌(PRAD)中上调并预测较差总生存(OS)的葡萄糖激酶。临床样本分析显示,与非PCa组织相比,ADPGK在PCa组织中显著上调。
ADPGK过表达促进了PCa细胞的增殖和迁移,而敲低ADPGK则抑制了恶性表型。
代谢组学、蛋白质组学以及ECAR和OCR测试揭示了ADPGK显著加速了PCa的糖酵解。
ADPGK与丙酮酸激酶C(ALDOC)结合,通过AMP激活蛋白激酶(AMPK)磷酸化促进糖酵解。

图2 用于ADPGK过表达的慢病毒结构示意图及ADPGK过表达结果。


实验设计和主要研究结果:
确认PHIs 诱导心肌细胞中的钙释放。 PHD2 在心肌细胞中激活肌浆网通道辅助蛋白 CaMKⅡ。用shRNA干扰技术敲低心肌细胞中PHD2,Western blot证实了PHD2的沉默。与对照细胞相比,沉默PHD2显著增加了CaMKⅡ的磷酸化。 Ca2+ 在心肌细胞中介导 PHI 刺激引起的 AMPK 激活。肌浆网通道抑制剂瑞安诺丁显著降低了PHI处理诱导的与Ca2+相关的荧光强度。慢病毒介导的RyR2特异性shRNA显著降低了RyR2在mRNA水平上的表达。此外, IP3R阻断剂2-APB预处理或慢病毒介导的IP3R特异性shRNA均未显著影响PHI处理诱导的P-AMPK水平。2-APB预处理对PHI诱导的Ca2+荧光也无显著影响。这些结果表明,PHI诱导的钙释放和AMPK激活主要由肌浆网通道而非IP3R通道调节。 CaMKⅡ介导PHI诱导的钙释放和AMPK激活。PKA不参与PHI/Ca2+/AMPK信号通路,而CaMKⅡ在PHI/Ca2+/AMPK信号通路中发挥着重要作用。 TRPA1介导PHI/Ca2+/AMPK信号通路的激活。TRPA1抑制剂HC030031预处理显著抑制了PHI诱导的P-AMPK和P-CaMKⅡ增加,并显著减少了PHI诱导的Ca2+荧光。PHD2 shRNA组中TRPA1蛋白水平显著高于对照组。这些结果强烈表明TRPA1在PHD诱导的Ca2+释放途径中发挥着至关重要的作用。

图3 慢病毒介导的特异性shRNA对 PHD2、RyR2和IP3R的敲低效果。


实验设计和主要研究结果:
LRP1在小鼠和猪的耳蜗细胞中广泛表达,尤其在BLB区域和目标细胞中。
通过靶向LRP1的配体肽IETP2,可以将不同的小分子如荧光染料、抗氧化药物和MRI造影剂等传递到内耳。这表明LRP1可能是一个有效的靶点,用于开发非侵入性和针对性的药物递送策略,以提高内耳疾病的治疗效果。
LRP1在细胞内吞作用中也起着关键作用。研究表明,IETP2肽与LRP1结合后可以被LRP1阳性细胞内化,并且这种内吞作用依赖于LRP1的表达。通过使用CRISPR/Cas9技术敲低LRP1基因,进一步证实了LRP1在IETP2内吞中的关键作用。
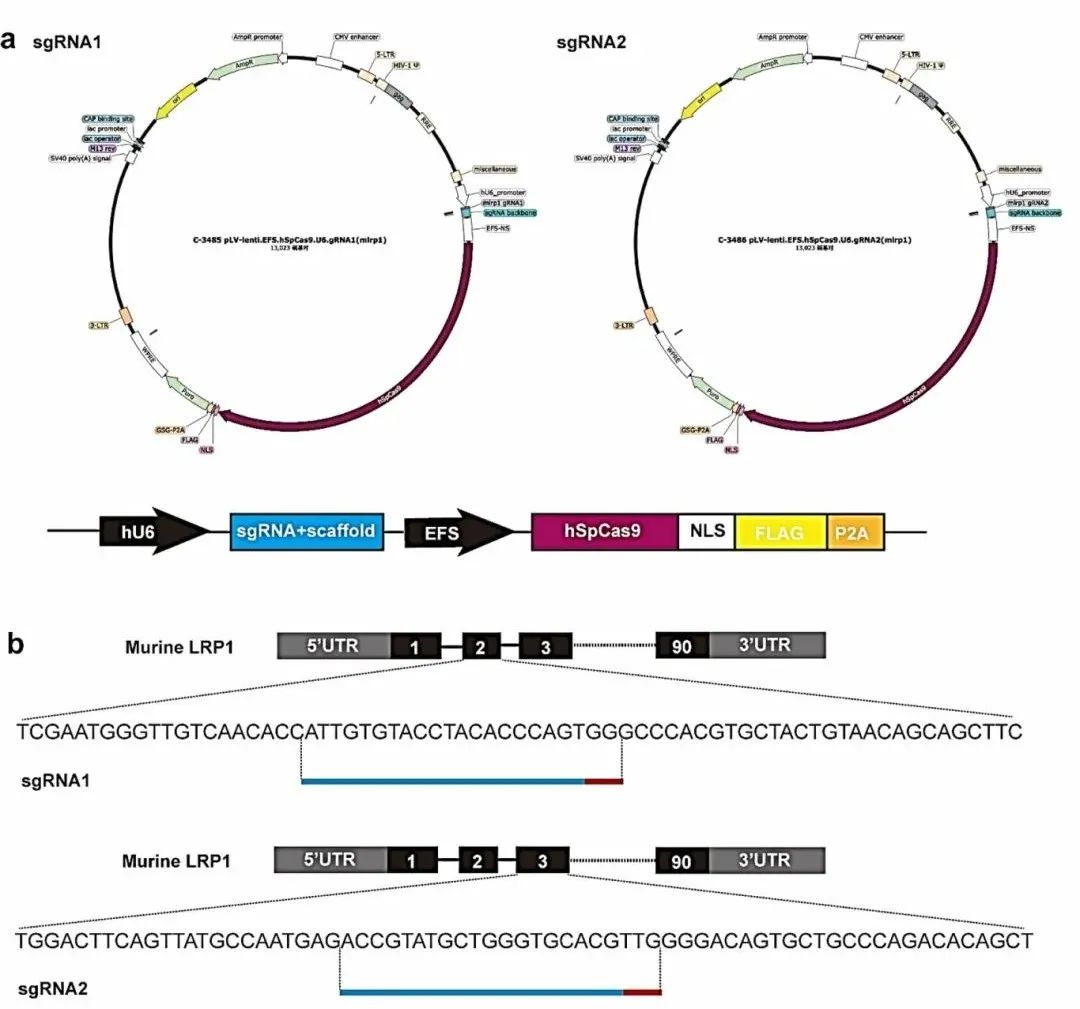
图4 用于敲低LRP1的慢病毒载体结构和sgRNA。
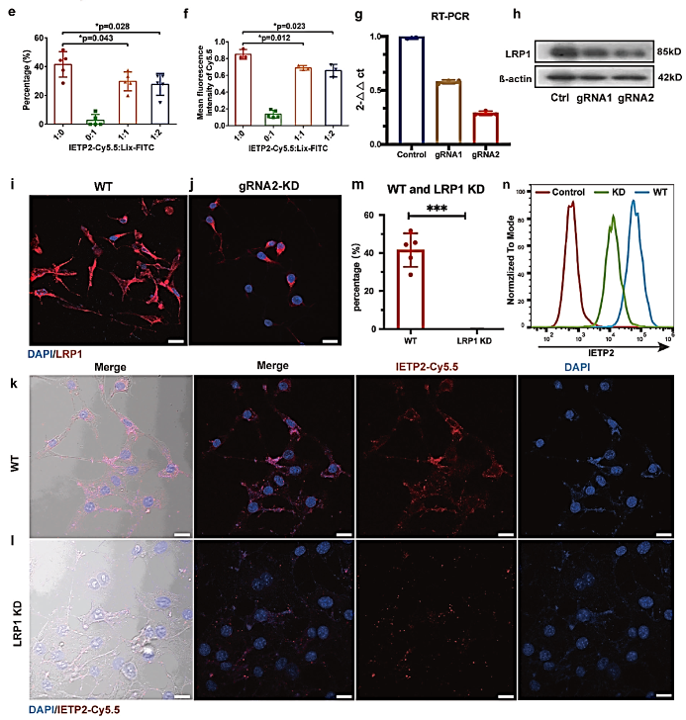
图5 LRP1的敲低效果。

派真生物有幸为以上三项研究提供慢病毒。

实验设计和主要研究结果:
Akaluc和Fluc报告基因的设计和灵敏度比较。用表达Venus-Akaluc或Venus-Fluc融合蛋白的慢病毒载体转导人GBM细胞系U87MG和小鼠高级别胶质瘤细胞系GL261,结果显示病毒载体转导对胶质瘤细胞的增殖率没有显著影响,表达Akaluc的细胞比表达Fluc的细胞的BLI信号强大约10倍。
颅内移植表达Akaluc的胶质瘤细胞产生超过Fluc 100倍的BLI信号。将GL261-Venus-Akaluc和GL261-MSCV-Fluc胶质瘤细胞颅内植入到同系的C57BL/6小鼠中,在所有时间点,Venus-Akaluc组的BLI信号显著高于GL261-Fluc组。
Akaluc BLI系统可以追踪更少数量的移植胶质瘤细胞,从而有助于更准确地模拟肿瘤发生和早期肿瘤生长。
Akaluc BLI系统可用于在体内对胶质瘤治疗反应进行纵向追踪。
总之,Akaluc BLI提供了一种敏感的方法用于体内追踪胶质瘤生长、侵袭和转移,特别适用于对较小的肿瘤进行成像以及监测治疗后的肿瘤复发。

图6 用于递送Akaluc BLI系统的慢病毒载体结构示意图以及Akaluc BLI系统体内示踪效果。

派真生物可提供表达Akaluc的慢病毒。
参考资料:
https://doi.org/10.1186/s40779-023-00500-9
https://doi.org/10.1016/j.yexcr.2021.112777
https://www.nature.com/articles/s41392-022-00995-z
https://doi.org/10.1007/s00259-021-05439-4






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论