
昨日,2024年诺贝尔生理学或医学奖正式揭晓,miRNA的发现者维克托·安博斯(Victor Ambros)和加里·鲁弗肯(Gary Ruvkun)获奖,“以表彰他们发现微小RNA(miRNA)以及其在转录后基因调控中的作用”。诺贝尔奖连续2年颁给RNA相关研究,这让不少人感到意外,但这两位科学家的开创性研究,揭开了基因调控认识的的新篇章,他们获奖绝对是实至名归的。DNA基因复制到信使RNA转录本,再指导蛋白质合成的“中心法则”仍然提供了连接遗传学与医学现象的基本框架。然而,正如在生物学和医学中经常遇到的情况一样,一些有趣的细节和例外情况总是会额外吸引人们的注意。从原核生物到真核生物的演化过程中,RNA分子在众多生物学功能中扮演着关键且多样化的角色。在这些RNA中,仅有一小部分是作为编码蛋白质的信使RNA(mRNA),而绝大多数RNA属于非编码RNA(non-coding RNA,ncRNA),那些长度不足200个核苷酸的非编码RNA被定义为小非编码RNA(small non-coding RNA,sncRNA)。经过长期深入的研究,研究者们根据小非编码RNA的尺寸和结构特征,将其归纳为三大类别:传统小RNA、结构小RNA和衍生小RNA(也被称作非规范小RNA)。这些小RNA通过各自独特的机制参与调控多样的生物过程,而miRNA正是传统小RNA中的一种,由于它的长度很短,仅有21-23个核苷酸组成,因此被称作微小RNA(miRNA)。miRNA的生物合成过程开始于较长的初级转录本(pri-miRNA),这些转录本经过核酸内切酶Drosha处理,形成具有茎环结构的前体miRNA(pre-miRNA)。随后,pre-miRNA被转运到细胞质中,并在那里被Dicer酶进一步剪切,产生成熟的miRNA。(图片来源:参考资料[3])
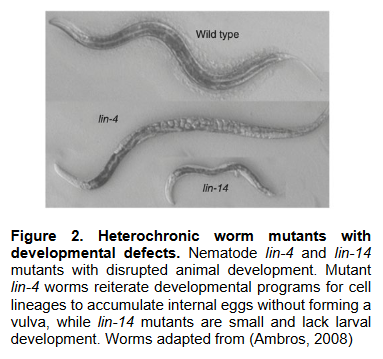
成熟的miRNA通常与RNA诱导沉默复合体(RISC)结合,形成活性复合物,进而与目标mRNA的3'非翻译区(3' UTR)或5'非翻译区(5' UTR)结合,实现基因表达的调控。简单来说就是,miRNA通过与靶mRNA的互补配对而在转录后水平上对基因的表达进行负调控,导致mRNA的降解或翻译抑制。那么为什么我们会需要miRNA对基因表达进行调控?存储在我们染色体中的信息可以比作我们体内所有细胞的说明书。但每个细胞包含相同的染色体,所以每个细胞包含完全相同的基因和完全相同的指令。然而,不同的细胞类型,如肌肉和神经细胞,有非常明显的差异。这些差异是如何产生的?答案就在于基因调控,它允许每个细胞只选择相关的指令。这就确保了在每种细胞类型中只有一组正确的基因是活跃的。Victor Ambros 和 Gary Ruvkun 正是对不同细胞类型如何发展感兴趣,进而发现了在基因调控中起着关键作用的微小RNA。现在已知人类基因组编码超过一千个微小RNA,他们的发现揭示了基因调控的一个全新维度。后续的研究也证明,微小RNA对于生物体的发育和功能至关重要。我们的器官和组织由许多不同种类的细胞构成,它们在DNA中携带相同的遗传信息。然而,这些细胞各自表达出一套独特的蛋白质。这一现象是如何实现的?关键在于对基因活性的精确调控,确保在每种特定细胞类型中只有适当的基因集被激活。这使得肌肉细胞、肠道细胞和不同类型的神经细胞等能够发挥它们的特化功能。此外,为了适应体内和环境中的变化,基因活性必须得到持续的微调。如果基因调控发生紊乱,可能会导致癌症、糖尿病或自身免疫性疾病等严重疾病。因此,理解基因活性的调控一直是多年来的研究重点。从单细胞祖先演化到多细胞生物的过程中,每种细胞类型都获得了专门的功能,这需要越来越复杂的基因调控机制。除了由DNA结合因子介导的转录基因调控外,随着生物体复杂性的增加,其他形式的控制系统也出现了。在数亿年的时间里,编码微小非编码RNA分子的基因,即所谓的miRNA,在多细胞生物的基因组中扩展,对mRNA的稳定性和蛋白质翻译进行转录后控制。miRNA及其基因调控模式在1993年由Victor Ambros和Gary Ruvkun发现之前,一直是完全未知的。在20世纪80年代末,安博斯和鲁弗肯作为博士后研究员在Robert Horvitz的实验室工作,后者与Sydney Brenner及John Sulston因研究秀丽隐杆线虫(C. elegans)而一同获得2002年诺贝尔奖。安博斯和鲁弗肯利用这种1毫米长的线虫作为模型生物,研究了控制不同细胞类型发育时间的基因。他们研究了两种突变蠕虫 lin-4 和 lin-14,它们在发育过程中基因程序的激活时间上表现出缺陷,希望能识别突变基因、了解它们的功能(参考资料[4,5])。1993年,安博斯和实验室的技术员Rosalind Lee及博士后Rhonda Feinbaum早先的研究表明,lin-4基因似乎是lin-14基因的负调节因子。然而,lin-14活性如何被lin-4阻断的详细机制尚不清楚。为了探究这一问题,安博斯和鲁弗肯进行了深入研究。安博斯成功克隆了lin-4基因,并发现它产生了一种异常短的RNA分子,这种miRNA并不编码蛋白质。鲁弗肯则研究了lin-14基因的调控机制,并发现lin-4不是通过抑制lin-14 mRNA的产生,而是通过不完全的碱基配对调控靶基因的表达,阻止其翻译成蛋白质。(图片来源:参考资料6)
鲁弗肯的研究发现,突变lin-4的成年线虫,长出幼嫩的皮肤,而突变掉lin-14的幼年线虫,则会长出皱皱的皮肤,原因竟是在线虫中lin-4可通过靶向lin-14基因的3’ UTR从而调控lin-14并抑制它的表达。lin-14蛋白在幼年线虫中大量富集,而在成年线虫大量减少。所以突变掉lin-4后,lin-14会增加,lin-14蛋白的大量富集会使得成年线虫长出幼嫩皮肤。(图片来源:参考资料[1])
他们的研究揭示了lin-4的miRNA序列与lin-14 mRNA中的互补序列相匹配,从而通过结合并抑制其翻译来关闭lin-14基因的表达。(图片来源:参考资料[1])
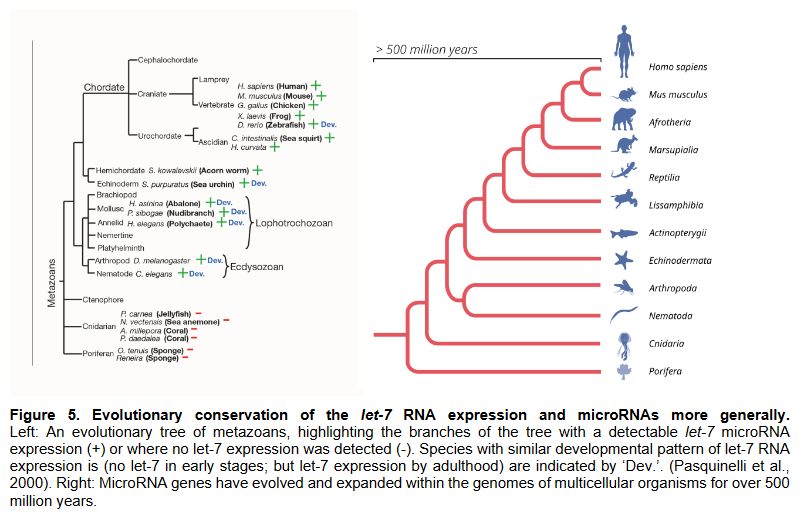
尽管这些发现足够证明miRNA调控基因表达的基本特征,但是由于lin-4仅在线虫中发现,当时尚未存在有力证据表明miRNA在其他生物体内可保守存在;并且从他们发现了第一个miRNA后,后续的7年期间再无新的miRNA被发现,也没有其他同行报道发现类似的非编码miRNA,所以安博斯等人也怀疑lin-4的发现是线虫发育的一个特例,并无推而广之的意义。在1993年到2000年期间,安博斯实验室陆陆续续发现lin-4/ lin-14的调控关系似乎具有广泛的意义。比如,lin-4不仅仅是调控lin-14,它同样可以通过靶向3’ UTR调控lin-28,表明lin-4/ lin-14的调控不是特例。还有就是,RNA干扰(RNA interference,一种具有双链结构的非编码miRNA干扰并沉默靶基因表达的现象)的发现——这一类在转录后期沉默基因表达的反义RNA,长度与lin-4竟然是一致的。这些现象都暗示miRNA lin-4的负向调控可能不是个例,也许还有潜在的类似具有调控功能的miRNA尚未被发现。由于该发现的前瞻性,当时并未引起很多科学家的重视,加上miRNA在当时被认为不具有普遍的调控意义,很多问题难以被解释,此后一段时间miRNA的相关研究基本处于停滞状态。2000年,鲁弗肯的研究小组发现了由let-7基因编码的另一种高度保守的miRNA,这一条具有21个核苷酸长度的非编码miRNA,通过靶向lin-41基因的3’ UTR降低 lin-41的表达,与lin-4的调控机制相同(参考资料[7])。他还证明了let-7在动物中的保守性,它在果蝇、斑马鱼、海胆和人类中都有表达。这一领域的研究因此受到了广泛关注,为后续miRNAs的研究打下铺垫。(图片来源:参考资料[1])
随后,数百种不同的miRNA被陆续发现,如今已知人类基因组中编码超过一千种不同的miRNA,这些miRNA在调控基因表达、细胞分化和组织发育等方面发挥着核心作用。从发现第一个miRNA到现在已有20多个年头,miRNA的研究目前可谓是进入了井喷时代。根据miRBase的最新数据统计显示,当前已发现的人类miRNA前体有1982条,成熟miRNA有2694条。目前,miRBase数据库包含了来自271个物种的超过38,000个发夹前体和48,860个成熟miRNA基因序列(参考资料[8])。甚至发现病毒也编码miRNA基因(参考资料[9])。随着miRNA 相关研究不断推进,miRNA在个体发育与疾病发生发展过程中的重要作用也不断地被揭示。多个研究团队的实验阐明了miRNA的生物合成机制以及它们如何被传递到目标mRNA的互补序列上。有趣的是,一个miRNA可以调控许多不同基因的表达,而一个基因也可能受到多个miRNA的调控,从而协调和微调整个基因网络。经过时间的积淀,miRNA对于基因调控的作用机制已经被研究得非常清晰。成熟的miRNAs(miRNAs)是长度大约为21至22个核苷酸的单链RNA分子。它们主要源自由RNA聚合酶II转录的初级转录本(pri-miRNA),该聚合酶也负责转录编码蛋白质的基因。值得注意的是,基因组中某些重复序列区域的miRNAs则由RNA聚合酶III进行转录。一些pri-miRNAs仅编码一个miRNA,而其他一些则编码多个miRNA,形成miRNA簇。在人类中,大约有一半的miRNA基因位于编码蛋白质的基因内含子内,其余的则散布在基因组的其他区域,或位于未翻译区域的外显子中。尽管pri-miRNA的合成调控机制尚未完全阐明,但已知一些转录因子能够同时调控蛋白质编码基因和pri-miRNA的表达。在pri-miRNA中,编码miRNA的序列会折叠成不完全的茎环状发夹结构。一个名为“微处理器”的核蛋白复合体,包含Drosha酶、双链RNA结合蛋白DGCR8以及其他辅助蛋白,负责从pri-miRNA中切割出含有发夹结构的pre-miRNA。这一切割过程使得pre-miRNA能够通过核孔复合体从细胞核转运到细胞质中。在细胞质内,含有Dicer酶的复合体进一步处理pre-miRNA,将其裁剪成成熟的miRNA。通常情况下,只有前体中的一条链会被保留并成为成熟的miRNA。这些成熟的miRNA随后会与miRISC结合,该复合体通常包含Argonaute家族蛋白,并负责执行miRNA介导的基因沉默。在众多miRNA序列中,5′端的“种子”区域(大约从第2个碱基到第8或第9个碱基)对于识别靶mRNA至关重要,同时miRNA的3′端与靶位点之间的序列上下文和碱基配对也对miRNA的功能发挥着重要作用。在动物体内,miRNA通过两种主要机制发挥作用:一是通过其种子序列与mRNA的3'非翻译区(3'UTR)进行互补配对,导致mRNA的翻译过程受到抑制,进而调控基因的表达;二是在翻译延伸阶段阻碍核糖体的移动,导致翻译提前终止。miRNA对mRNA表达和翻译的调控作用,使其在基因表达调控中扮演着关键角色。基因表达改变是导致人类疾病(包括癌症)病理过程的主要分子机制,miRNA在疾病相关的多个领域展现出巨大的应用潜力,原因在于其能够精准调控细胞内的基因表达,通过影响特定的细胞途径来治疗疾病。miRNA的调控作用不仅限于单一基因,它们能够同时影响多个靶基因,从而对细胞功能产生广泛影响。这种调控机制使得miRNA成为治疗多种疾病的有力候选,包括癌症、心血管疾病和神经退行性疾病。
改变细胞内miRNA的表达水平是miRNA治疗的关键策略之一。通过使用合成miRNA(miRNA mimics)来增加细胞内特定miRNA的浓度,可以增强其对靶基因的调控作用。相反,通过使用miRNA抑制剂(anti-miRs)可以降低特定miRNA的活性,从而减轻其对靶基因的抑制。此外,还可以利用重组表达载体来控制miRNA的表达,这些载体可以将miRNA编码序列直接导入细胞,实现对miRNA水平的精确调控(参考资料[10])。
(图片来源:参考资料[2])
miRNA在疾病预防、监测与治疗等领域都有巨大的应用前景。在疾病预防方面,例如孕妇早期摄入叶酸可调节miRNA,从而降低胎儿神经管缺陷的风险。在疾病监测领域,随着检测技术的进步,miRNA的应用价值不断凸显。循环miRNA因其在体液中的稳定性成为重要的疾病标志物,像特定的miR-155和let-7a可用于癌症诊断,液体活检中血液里的循环miRNA用于无创诊断,有助于体液样本分析,同时在预测癌症治疗反应上也发挥作用。而在疾病治疗方面,miRNA的潜力更是不可小觑。它能够精准调控细胞内基因表达,同时影响多个靶基因,为癌症、心血管疾病和神经退行性疾病等多种疾病的治疗带来希望。改变细胞内 miRNA 表达水平的多种策略,如使用合成 miRNA、抑制剂和重组表达载体等的研究正在进行,且初步临床试验表明 miRNA在治疗多种疾病方面已经显示出潜力,虽然临床应用面临挑战,但这也为其应用潜力的进一步挖掘提供了优化改进的方向。安博斯和鲁弗肯的开创性工作,以及许多研究者在他们发现的基础上所做的研究,为我们揭开了基因调控的新篇章,彻底改变了我们对转录后基因调控的理解。在细胞核中,蛋白质通过与DNA结合因子相互作用调控RNA的转录和剪接过程,而在细胞质中,miRNA控制着mRNA的翻译和降解。这种转录后基因调控机制对于动物的发育至关重要,并在成年个体的细胞类型中发挥着关键作用,是复杂多细胞生物体生存的基础。[1] http://www.nobelprizemedicine.org/the-nobel-prize-in-physiology-or-medicine-2024/[2] Xiong Q, Zhang Y. Small RNA modifications: regulatory molecules and potential applications. J Hematol Oncol. 2023;16(1):64. Published 2023 Jun 22. doi:10.1186/s13045-023-01466-w.[3] Boyd SD. Everything you wanted to know about small RNA but were afraid to ask. Lab Invest. 2008;88(6):569-578. doi:10.1038/labinvest.2008.32.[4] Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75(5):843–854.[5] Wightman B, Ha I, Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 1993;75(5):855–862.[6] Neilson JR, Sharp PA. Small RNA regulators of gene expression. Cell. 2008;134(6):822-825. doi:10.1016/j.cell.2008.09.006.[7] Pasquinelli AE, et al. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature. 2000;408(6808):86–89. https://doi.org/10.1038/35040556.[8] Kozomara A, Birgaoanu M, Griffiths-Jones S. miRBase: from microRNA sequences to function. Nucleic Acids Research. 2019;47(D1):D155–D162. https://doi.org/10.1093/nar/gky1141.[9] Pfeffer S, et al. Identification of virus-encoded microRNAs. Science (New York, N.Y.). 2004;304(5671):734–736. https://doi.org/10.1126/science.1096781.[10] Diener C, Keller A, Meese E. Emerging concepts of miRNA therapeutics: from cells to clinic. Trends Genet. 2022;38(6):613-626. doi:10.1016/j.tig.2022.02.006.云舟生物科技(广州)股份有限公司创建于2014年,是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“VectorBuilder”平台(即“载体家”),开启了定制化基因载体的商品化时代,已累计向全球90多个国家和地区超4500家科研院校和制药公司提供服务,成果被上千篇Science、Nature、Cell等全球顶尖科研期刊广泛引用。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。




















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论