

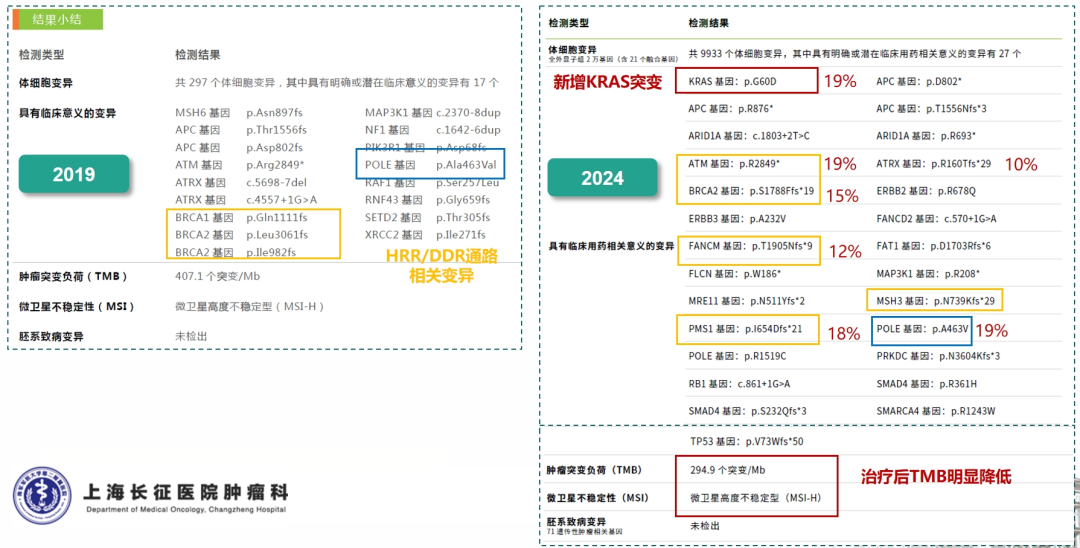
患者女性,61岁;结肠癌术后8年余。

1.MSI-H肠癌免疫治疗耐药的机制?
2.患者后续治疗应对策略?
1.MSI-H肠癌免疫治疗耐药的机制?

PARP抑制剂:Bhamidipati 等人[15]报道了6 名携带BRCA突变的CRC患者后线接受PARPi单药治疗后均发生疾病进展。1例携带BRCA2胚系突变的mCRC患者接受奥拉帕利+替雷利珠单抗+贝伐珠单抗治疗后获得了5.4个月的PFS,生存期超过26个月[16]。一项II期篮子研究[17]中共有31名转移性pMMR患者接受durvalumab+奥拉帕利或西地尼布治疗,在28名可评估的患者中,25 名出现病情进展。表明ICB联合PARP抑制剂在pMMR-CRC中似乎抗肿瘤活性有限,但在dMMR的结直肠癌中罕有相关报道。 PD-1联合MEK抑制剂:IMblaze 370 III期研究[18]结果显示,阿替利珠单抗+考比替尼联合方案和瑞戈非尼标准三线治疗在肠癌中的疗效相似。因研究纳入的MSI-H患者数量较少(n=6),亚组分析也未能明确MSI-H患者最佳获益方式。 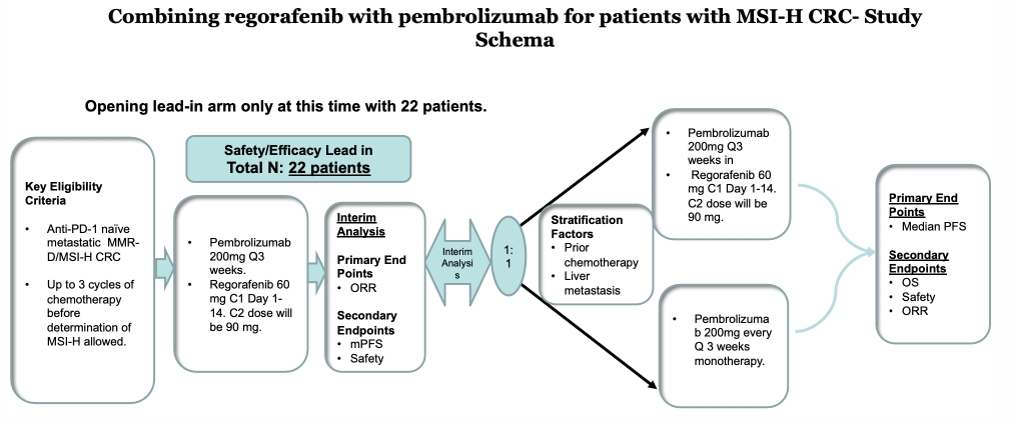
抗血管联合免疫治疗:探索性研究表明,相比MSS型肠癌,MSI-H的患者更有可能从抗 VEGF 治疗中获益。II期 REGPEM-CRC-01 研究旨在评估瑞戈非尼+帕博利珠单抗在MSI-H/dMMR型晚期肠癌一线治疗的价值,该研究正在进行中,预期能够使中位 PFS从 16个月提高到28个月[19]。
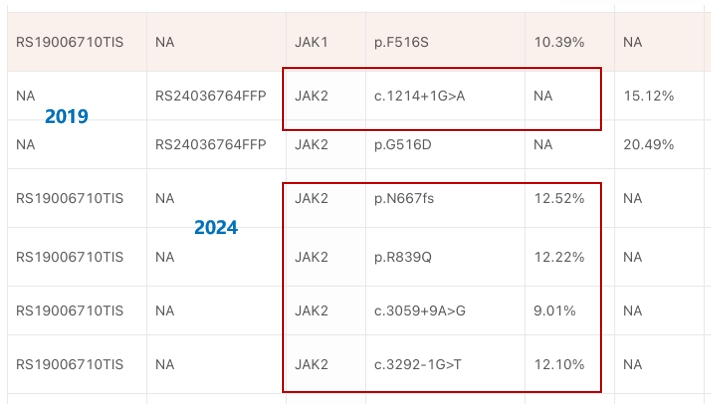
王湛教授:该患者肺部病灶手术切除后,目前使用免疫在维持。结合上述分析,PARP抑制剂可能是后续治疗可干预的手段之一,联合免疫治疗理论上也具有可行性;此外,近期在Science发表了两篇关于使用JAK抑制剂逆转免疫耐药的文章,分别在肺癌和淋巴瘤中。然而目前在肠癌中还是空白,这也让我们联想到是否有使用JAK抑制剂的可能性。
参考文献
1.Annu Rev Immunol. 2022 Apr 26;40:45-74.
2.Br J Cancer. 2019 Nov;121(10):809-818.
3.Cell. 2016 Oct 6;167(2):397-404.e9.
4.N Engl J Med. 2016 Sep 1;375(9):819-29.
5.Genome Med. 2017 May 24;9(1):46.
6.Kopetz, S et al, AACR, 2018
7.JCO Precis Oncol. 2019;3:PO.18.00321.
8.J Clin Oncol. 2022 Aug 20;40(24):2735-2750.
9.Nat Commun. 2017 Oct 26;8(1):1136.
10.NCCN Guidelines Version 5.2024 Colon Cancer
11.Clin Cancer Res. 2021 Aug 15;27(16):4587-4598.
12.J Clin Oncol. 2022 Aug 20;40(24):2735-2750
13.Front Immunol. 2022 Sep 27;13:1016646.
14.Cell Host Microbe. 2023 May 10;31(5):781-797.e9.
15.Bhamidipati D, et al. 2024 ASCO
16.Life (Basel). 2023 May 15;13(5):1183.
17.Clin Colorectal Cancer. 2024 Sep;23(3):272-284.
18.Lancet Oncol. 2019 Jun;20(6):e293.
19.2024 ASCO GI TPS238.
关于燃石医学
燃石医学(伦敦交易所代码/纳斯达克代码:BNR)成立于2014年,公司使命为“用科学守护生命之光”,专注于开发创新可靠、具有临床价值的癌症伴随诊断与早检产品。公司业务及研发方向主要覆盖:1)癌症患病人群精准医学检测;2)全球抗肿瘤药企的生物标志物和伴随诊断合作;3)基于液体活检的多癌种早检。燃石医学于2018年7月获国家药品监督管理局(NMPA)颁发的中国肿瘤NGS检测试剂盒第一证,在体外诊断领域具有里程碑式意义。实验室获得广东省临检中心颁发的 “高通量测序实验室”技术审核,同时获得美国CLIA、CAP和ISO15189实验室质量体系资质认证。公司将继续致力于开发创新可靠的癌症精准检测产品,推动癌症精准医疗领域的发展。
























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论