
1
MAYEX is an old long noncoding RNA recruited for X chromosome dosage compensation in a reptile
MAYEX是一种古老的长链非编码RNA,用于爬行动物的X染色体剂量补偿
发表期刊:Science
影响因子:44.7
发表时间:2024年9月20日
长链非编码RNAs(lncRNAs)是性染色体的重要调节元件,其作用是可平衡雄性和雌性之间的基因表达水平。XIST、RSX和roX2分别调节胎盘哺乳动物、有袋动物和果蝇的X染色体。因为安乐蜥(Anolis carolinensis)显示出其X染色体的完全剂量补偿,本研究测试了lncRNA是否参与其中。结果发现了一种古老的lncRNA MAYEX,它在8900多万年前获得了雄性特异性表达。MAYEX进化出与乙酰化组蛋白4赖氨酸16(H4K16ac)表观遗传标记的显著关联,并能够将其位点环绕至X染色体的全部以提高表达水平。MAYEX是爬行动物中第一个与平衡性染色体表达的剂量补偿机制相关的lncRNA。
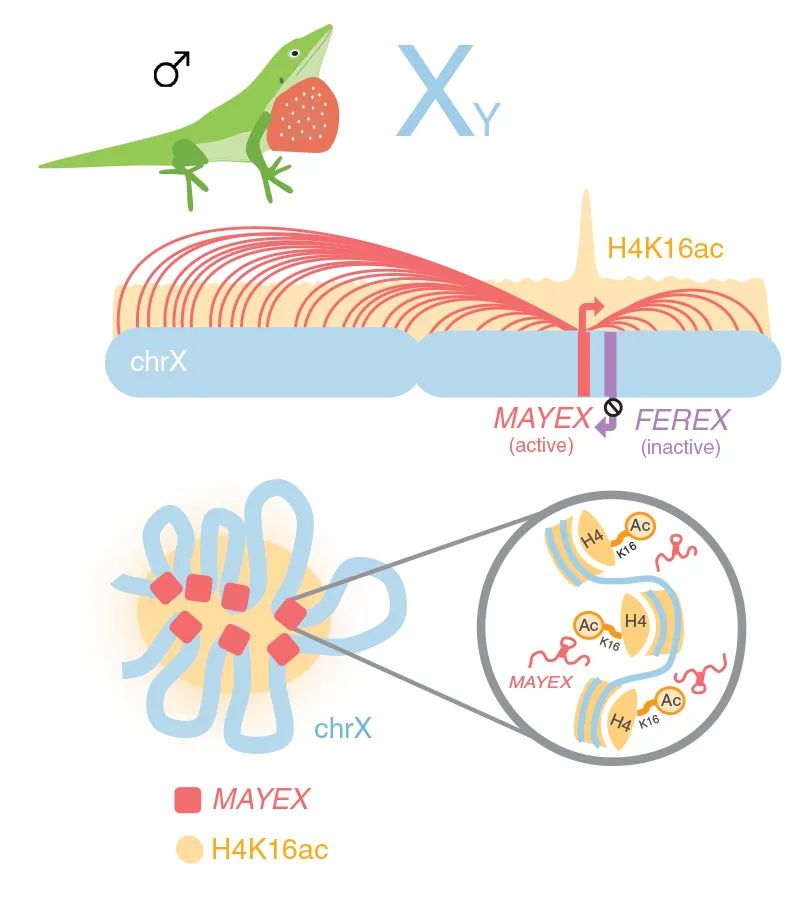
Fig1. A. carolinensis中X染色体剂量补偿的模型
原文链接:
https://pubmed.ncbi.nlm.nih.gov/39298575/
2
LncRNA FAISL Inhibits Calpain 2-Mediated Proteolysis of FAK to Promote Progression and Metastasis of Triple Negative Breast Cancer
LncRNA FAISL抑制Calpain 2介导的FAK蛋白水解促进三阴性乳腺癌的进展和转移
发表期刊:Adv Sci (Weinh)
影响因子:14.3
发表时间:2024年9月17日
三阴性乳腺癌(TNBC)是乳腺肿瘤中最具侵袭性的亚型。在重新分析TCGA乳腺癌数据集时,研究人员发现细胞粘附分子在TNBC样本中高度富集于差异表达基因,其中Focal adhesion Kinase(FAK)与TNBC患者生存不良的相关性最显著。FAK在黏着斑动力学中受到精确调节。为了研究lncRNAs是否调节FAK信号传导,研究人员进行了RNA免疫沉淀测序,发现FAISL(FAK相互作用和稳定LncRNA)在FAK相互作用的lncRNA中大量富集,并且经常在TCGA TNBC组织中过表达。FAISL促进TNBC细胞粘附、细胞骨架扩散、增殖和非锚定性存活。FAISL不影响FAK mRNA,但通过阻断Calpain 2介导的蛋白水解来正向调节FAK蛋白水平。FAISL与FAK的C端结构域相互作用,从而掩盖Calpain 2的结合位点并防止FAK切割。高水平的FAISL与肿瘤组织中FAK的表达和TNBC患者的不良预后相关。使用还原反应性纳米颗粒靶向FAISL的siRNA递送系统可有效抑制TNBC小鼠模型中的肿瘤生长和转移。总之,这些发现揭示了lncRNA介导的在TNBC进展中调节FAK蛋白水解的机制,并强调了靶向lncRNA FAISL治疗TNBC的潜力。
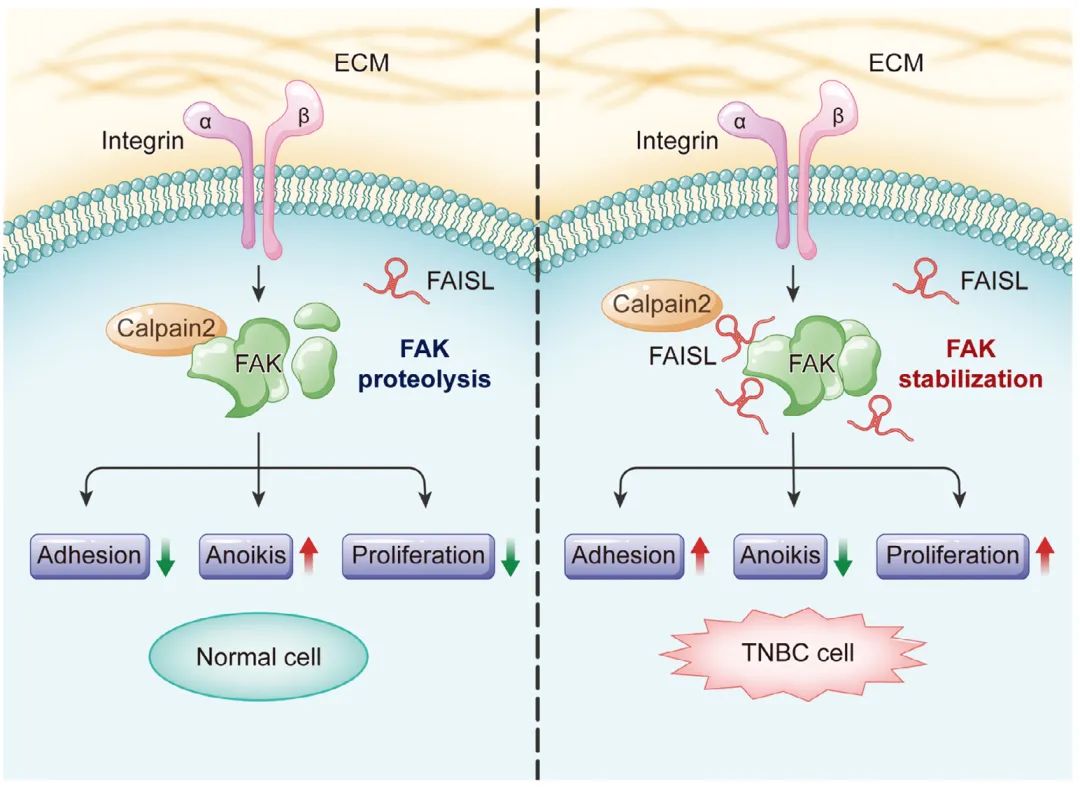
Fig2. lncRNA FAISL通过增强FAK稳定性促进TNBC进展和转移的工作模型
原文链接:
https://pubmed.ncbi.nlm.nih.gov/39287113/
3
The long non-coding RNA ROSALIND protects the mitochondrial translational machinery from oxidative damage
长链非编码RNA ROSALIND保护线粒体翻译机制免受氧化损伤
发表期刊:Cell Death Differ
影响因子:13.7
发表时间:2024年9月18日
线粒体呼吸的上调与高ROS清除能力相结合是几种癌症中耐药细胞的共同特征。由于翻译保真度对于细胞适应性至关重要,因此保护线粒体和胞质核糖体免受氧化损伤至关重要。虽然细胞质中存在识别和修复此类损伤的机制,但线粒体中的相应过程仍不清楚。本研究确定了核编码的lncRNA ROSALIND是核糖体的相互作用伙伴。ROSALIND在复发性肿瘤中上调,其表达可以区分黑色素瘤患者队列中免疫检查点阻断的应答者和无应答者。ROSALIND具有异常高的G含量,可作为氧化底物。因此,抑制ROSALIND会导致ROS和蛋白质氧化增加,导致严重的线粒体呼吸缺陷。这反过来又会损害黑色素瘤细胞的活力,并增加临床前人源化癌症模型中体外和离体的免疫原性。这些发现强调了ROSALIND作为一种新型ROS缓冲系统的作用,保护线粒体翻译免受氧化应激的影响,并阐明了克服癌症治疗耐药性的潜在治疗策略。

Fig3. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/39294440/
4
Cooperative application of transcriptomics and ceRNA hypothesis: lncRNA-00742/miR-116 targets CD74 to mediate vanadium-induced mitochondrial apoptosis in duck liver
转录组学与ceRNA假说的协同应用:lncRNA-00742/miR-116靶向CD74介导钒诱导的鸭肝脏线粒体凋亡
发表期刊:J Hazard Mater
影响因子:12.2
发表时间:2024年9月18日
钒(V)是一种有毒的金属环境污染物,对动物的肝脏健康构成危害。竞争性内源性核糖核酸(ceRNAs)是线粒体功能和细胞凋亡的重要组成部分,它们的作用与金属毒性机制有关。然而,ceRNAs在V诱导的肝脏线粒体凋亡中的特异性机制尚未得到充分研究。因此,本研究建立了鸭暴露于V 44天的体内模型和V暴露鸭肝脏细胞敲低/过表达的体外模型。结果显示,V暴露触发了肝脏中1106个lncRNAs和11个miRNAs的差异表达。此外,研究人员通过双荧光素酶报告基因建立了lncRNA-00742/miR-116/CD74调控网络。研究结果还发现V诱导线粒体损伤并上调线粒体细胞凋亡相关因子的表达水平。此外,敲低miR-116可减轻V诱导的肝细胞线粒体损伤和细胞凋亡。相比之下,miR-116的过表达和CD74的敲低加剧了线粒体损伤和细胞凋亡。BTZO-1上调CD74水平并减轻V诱导的线粒体凋亡。综上所述,V通过激活lncRNA-00742/miR-116/CD74轴诱导鸭肝脏线粒体损伤和细胞凋亡。本研究首先揭示了lncRNA相关ceRNAs调控V诱导的线粒体凋亡的机制。

Fig4. 研究模型示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/39303616/
5
LncRNA-HMG incites colorectal cancer cells to chemoresistance via repressing p53-mediated ferroptosis
LncRNA-HMG通过抑制p53介导的铁死亡诱导结直肠癌细胞产生化疗耐药性
发表期刊:Redox Biol
影响因子:10.7
发表时间:2024年9月19日
化疗后,过量的活性氧(ROS)通常会导致癌细胞产生大量脂质过氧化物并诱导细胞死亡,即铁死亡。ROS 的消除是肿瘤细胞摆脱铁死亡并获得耐药性的关键。然而,长链非编码RNAs (lncRNAs)在ROS代谢和肿瘤耐药性中的确切功能仍然不清楚。本研究通过高通量筛选将LncRNA-HMG鉴定为结直肠癌(CRC)中化疗耐药相关的lncRNA。LncRNA-HMG的异常高表达预示着CRC患者的预后较差。同时,研究发现LncRNA-HMG保护CRC细胞在化疗时免受铁死亡,从而增强CRC细胞的耐药性。LncRNA-HMG与p53结合并促进MDM2介导的p53降解。p53的降低诱导SLC7A11和VKORC1L1的上调,这有助于增加还原剂的供应并消除过量的ROS。因此,CRC细胞从铁死亡中逃脱并获得化疗耐药性。重要的是,在患者来源的异种移植物(PDX)模型中,反义寡核苷酸(ASO)对LncRNA-HMG的抑制使CRC细胞对化疗显著敏感。LncRNA-HMG也是β-catenin/TCF的转录靶标,激活的Wnt信号可触发LncRNA-HMG的显著上调。总的来说,这些发现表明LncRNA-HMG促进CRC化疗耐药,可能是CRC的预后或治疗靶点。
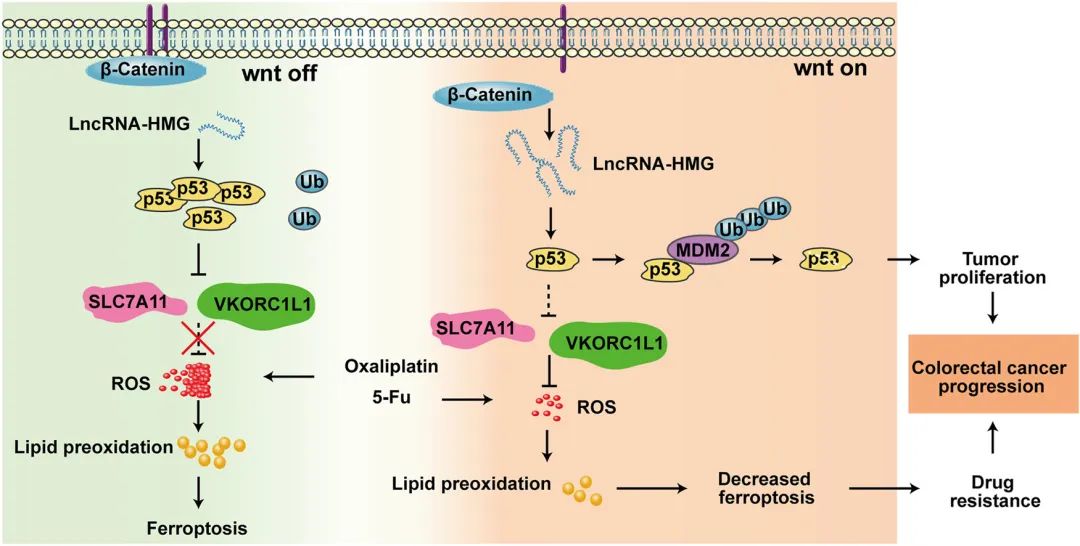
Fig5. 研究模型示意图
原文链接:
https://www.sciencedirect.com/science/article/pii/S2213231724003409
END



联系我们
电话:400 686 0075
邮箱:marketing@ribobio.com
官网:www.ribobio.com
点击 阅读原文 了解更多资讯!
























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论