PD-1(Programmed cell death 1)免疫治疗是一种革命性的癌症治疗方法,它利用人体自身的免疫系统来对抗肿瘤。PD-1表达在T细胞表面的免疫检查点蛋白,它通过与PD-L1(Programmed cell death ligand 1)和PD-L2(Programmed cell death ligand 2)等配体结合来调节免疫系统的反应。在正常情况下,PD-1途径有助于防止过度的免疫反应和自身免疫疾病【1】。然而,一些肿瘤细胞会过度表达PD-L1,与T细胞表面的PD-1结合,从而抑制T细胞的活性,使肿瘤能够逃避免疫系统的监视和攻击,PD-1抗体通过特异性结合PD-1阻断PD-1与其配体PD-L1和PD-L2的结合,从而恢复T细胞的活性,使它们能够识别并攻击肿瘤细胞。这种治疗方法被称为免疫检查点阻断疗法【2】。
近期,复旦大学附属中山医院的樊嘉/代智团队在《Cancer Communications》(IF=20.1)上发表文章“Targeting SRSF10 might inhibit M2 macrophage polarization and potentiate anti-PD-1 therapy in hepatocellular carcinoma” 文章主要讨论了SRSF10在肝细胞癌中的作用以及其PD-1疗法的潜在影响。研究发现,SRSF10在肝细胞癌中高表达,并与肿瘤相关巨噬细胞(M2型巨噬细胞)的极化相关。通过抑制SRSF10的表达,可以抑制M2型巨噬细胞的极化,并增强PD-1疗法的治疗效果。这项研究为肝细胞癌的治疗提供了新的靶向治疗策略,并提出了潜在的联合治疗方案。


研究背景
免疫检查点治疗是一种革命性的癌症治疗手段,它通过靶向免疫系统中的抑制性信号通路,如PD-1/PD-L1(Programmed cell death 1 ligand 1),来增强机体对肿瘤的免疫反应【3】。在肝癌治疗领域,尽管这种疗法对某些患者有效,但总体响应率仍然不高,且效果受限于肿瘤的异质性和免疫微环境的抑制性。最新的研究进展集中在改善免疫微环境方面,如通过抑制SRSF10来促进M2型巨噬细胞向M1型的转变,从而增强抗肿瘤免疫反应。研究不仅增强了我们对肝癌免疫逃逸机制的理解,也为开发新的治疗策略提供了科学依据。

研究结果
1.SRSF10是HCC患者抗PD -1耐药和免疫抑制微环境相关的关键基因

作者通过单核RNA测序(snRNA-seq),KEGG富集分析对6名接受PD-1治疗的肝细胞癌(HCC)患者进行分析发现,4位患者对免疫治疗具有耐受性。在这些具有耐受性的患者中,葡萄糖代谢途径更加富集(图1C-D)。所以推断葡萄糖代谢与免疫治疗耐药性之间存在密切关系。随后作者通过数据分析发现,SRSF10在肿瘤中普遍过表达,随后作者通过实验发现shSrsf10可以显著减小肿瘤大小,并且可以使肿瘤微环境(Tumor microenvironment,TME)中肿瘤细胞丰度显著降低,并增加CD4+ T和CD8+ T细胞的比例,而Srsf10影响的这一过程与巨噬细胞相关。这些结果表明,SRSF10在HCC肿瘤中发挥了重要的作用,并与PD-1免疫治疗的耐药性相关(图1)

图1:SRSF10是一个与HCC中的抗PD-1耐药性和免疫抑制微环境密切相关的关键基因
2.SRSF10的诱导导致M2巨噬细胞的极化,从而建立了一个免疫抑制性肿瘤微环境

基于以上结果,研究人员假设SRSF10通过调节M2型巨噬细胞的极化来诱导肝细胞癌(HCC)中的免疫抑制肿瘤微环境(Tumor microenvironment,TME)。研究者将对照和shSrsf10 HCC肿瘤的scRNA-seq进行分析,发现在Srsf10敲低的小鼠肿瘤中抗肿瘤巨噬细胞标志物表达高于对照(图2 A),这说明巨噬细胞从促肿瘤到抗肿瘤的转变由Srsf10介导。研究人员使用THP1细胞(一种人单核细胞白血病细胞系)和从小鼠骨髓中提取的巨噬细胞(BMDMs)与SRSF10敲低的HCC细胞共培养,发现促肿瘤巨噬细胞标志物的表达量显著下调。而后研究者通过药物的方式消耗巨噬细胞,发现shSrsf10肿瘤的体积不再减少,最终与对照组相当(图2G-H)。随后作者对CD8+ T在shSrsf10的HCC肿瘤中的功能进行验证,结果发现shSrsf10的HCC细胞显著抑制CD8+ T细胞的增殖(图2L-M)。
这些结果表明肿瘤细胞的SRSF10表达通过促进巨噬细胞向具有促肿瘤表型的细胞转化,从而阻碍CD8+ T的浸润。
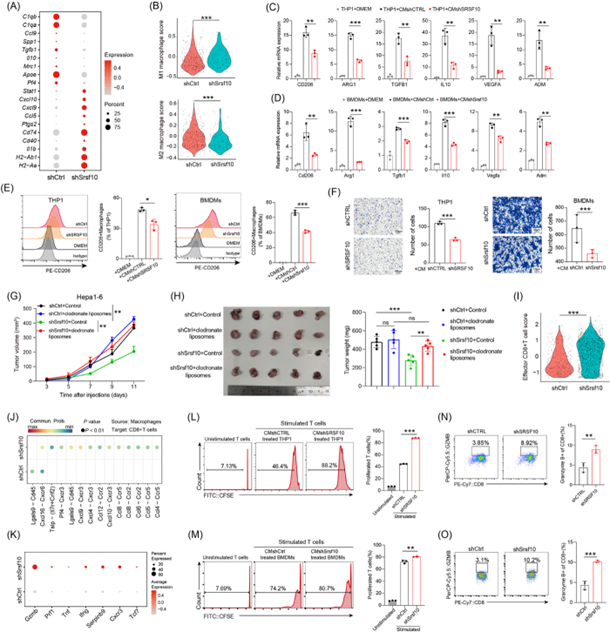
图2: SRSF10通过M2型巨噬细胞极化诱导免疫抑制性肿瘤微环境
3.SRSF10通过乳酸促进巨噬细胞M2极化

接着研究团队探究了SRSF10如何通过调节乳酸产生来促进M2型巨噬细胞的极化,并影响肿瘤微环境TME。SRSF10与糖酵解密切相关,而糖酵解在通过乳酸产生的TME中有至关重要的作用。作者首先验证了乳酸在SRSF10调节巨噬细胞极化的作用。在shSrsf10 HCC细胞和BMDMs共培养实验模型中引入乳酸,结果发现添加乳酸之后巨噬细胞M2的标志物表达升高,巨噬细胞的迁移能力增加,这与未加乳酸时的效果完全相反(3A-D)。乳酸会通过多种机制发挥作用,对乳酸分子机制的研究发现,乳酸可以通过影响组蛋白修饰来改变巨噬细胞的极化(图3H)。SRSF10的敲低通过影响乳酸产生和巨噬细胞极化来促进免疫抑制性肿瘤微环境的形成。这表明SRSF10可能是评估免疫治疗反应的潜在生物标志物。
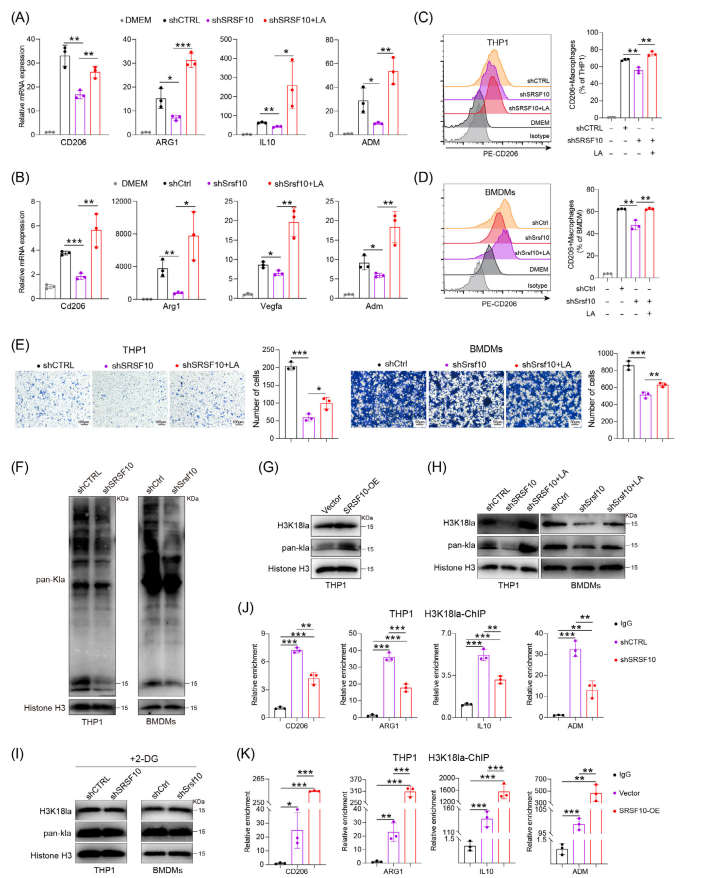
图3: SRSF10通过乳酸促进M2型巨噬细胞极化
4.SRSF10/糖酵解/H3K18la在HCC肿瘤细胞中形成正反馈回路

研究者探讨了SRSF10如何通过乳酸促进巨噬细胞向M2表型的极化,这一过程与糖酵解以及肝细胞癌(HCC)中免疫抑制肿瘤微环境(TME)的形成的关系。研究者通过对shSRSF10 Huh7大量RNA测序和数据分析发现糖酵解途径相关的基因在高SRSF10的患者体内显著富集(图4 B)。随后通过非靶向能量代谢测序发现在shSRSF10组中糖酵解相关代谢产物丰度显著降低,此外,碳代谢途径中的差异代谢物显著富集(图4C)。为了确认哪种乳酸蛋白特异性介导乳酸的分泌和上调,使用了抑制剂MCT1和MCT4结果发现MCT4介导SRSF10正向调节乳酸产生。作者进一步探究了组蛋白乳酸化修饰的作用,说明组蛋白乳酸化修饰会导致SRSF10的转录激活(图4L)形成了SRSF10/糖酵解/ H3K18la的正反馈循环(图4M),改变肿瘤微环境,从而可能增强免疫治疗的效果。
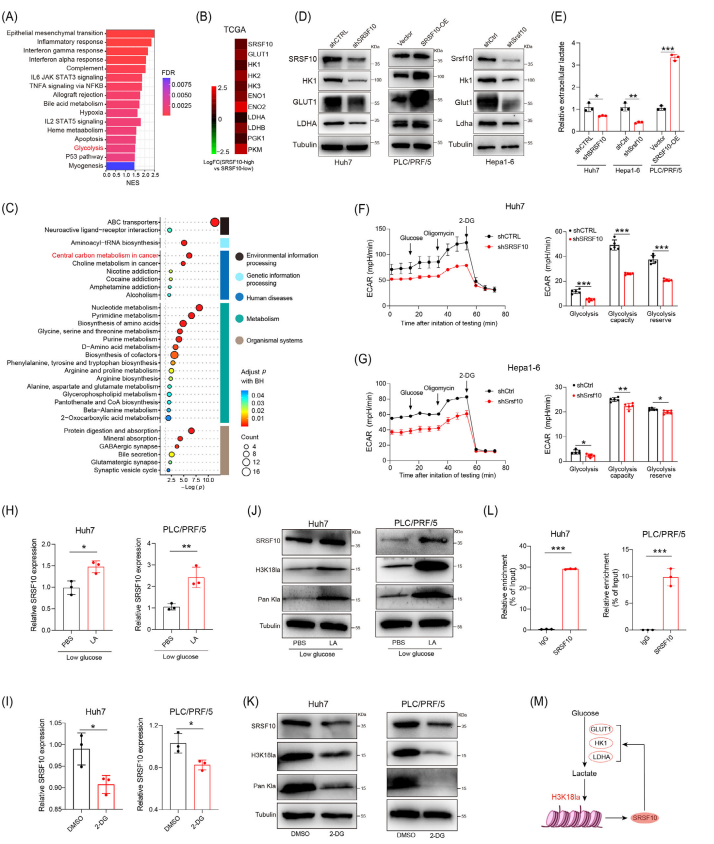
图4:SRSF10正向调节HCC细胞的糖酵解
5.SRSF10通过转录因子MYB调控肿瘤细胞的糖酵解过程

研究结果揭示了SRSF10在肝细胞癌中的一个关键作用,即SRSF10主要通过RNA结合活性发挥作用,作者使用TCGA-LIHC数据鉴定以及RIP-seq的数据分析后选择了与SRSF10相关性最强的MYB作为候选基因(图5B),之后通过PCR以及西方免疫印迹实验分析发现SRSF10正调控MYB的表达。为了进一步探索SRSF10除剪切功能以外调节RNA稳定性的机制,作者使用放线菌素d处理肿瘤细胞,抑制肿瘤细胞总RNA的表达,发现shSrsf10通过直接与MYB mRNA的3'UTR结合,增强了MYB RNA的稳定性,从而增加了MYB蛋白的表达。
1C8可以选择性的促进SRSF10的去磷酸化,在体内抑制肿瘤的表达。在实验中引入1C8后SRSF10的活性被抑制,下调了野生型HCC细胞中MYB的表达,而1C8应用于shSrsf10细胞未产生影响,说明1C8通过SRSF10介导MYB的调控。另外,研究者发现MYB干扰还会显著降低细胞外乳酸的水平。以上结果表明,SRSF10通过直接与MYB mRNA的3'UTR结合,增强了MYB RNA的稳定性,从而增加了MYB蛋白的表达。MYB作为一种转录因子,进一步激活了糖酵解相关基因的表达,进而增加乳酸的积累,形成SRSF10/糖酵解/ H3K18la正反馈循环。
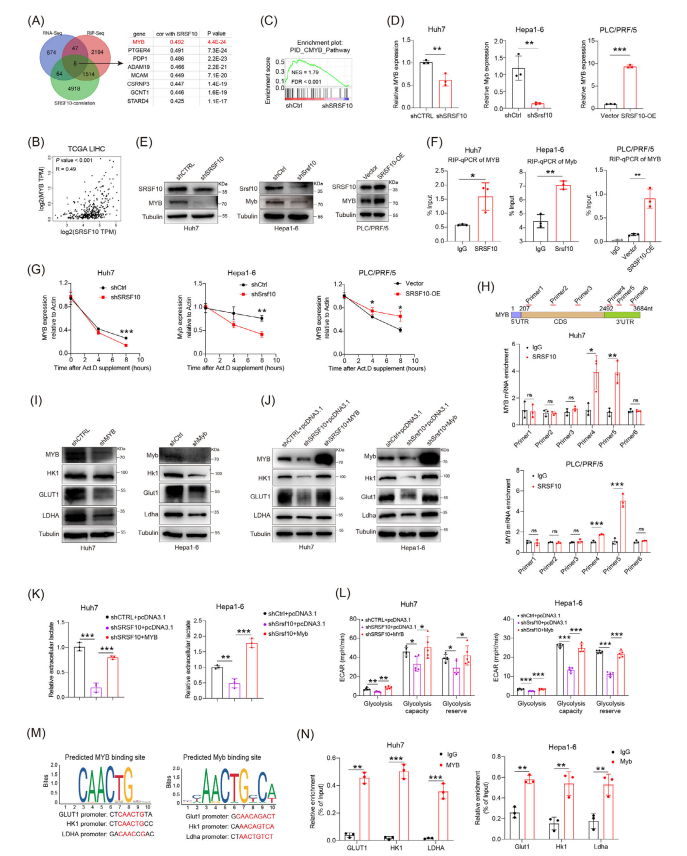
图5:SRSF10通过转录因子MYB正向调节肿瘤细胞的糖酵解
6.shSRSF10或1C8抑制阻碍了HCC的肿瘤进展并增强了免疫治疗反应

作者研究了SRSF10缺失是否增强PD-1单克隆抗体治疗的效果。研究者给接种shSrsf10或对照Hepa1-6细胞的免疫正常小鼠注射了PD-1 mab 或IgG的同型对照(图6A),结果发现shSrsf10和PD-1 mab联合治疗的方式要优于单独治疗(图6B-D),联合治疗的方式可以显著改变肿瘤微环境,增加肿瘤浸润性细胞毒性CD8+T细胞群,同时减少F4/80+和CD206+巨噬细胞(图6E)。
为了进一步抑制肿瘤生长,作者使用shSRSF10 Hepa1-6小鼠模型中引入1C8抑制剂(图6F),结果发现,1C8在体内的功能由SRSF10介导,能够在不影响小鼠体重的情况下减弱肿瘤的生长(图6G),经过分析发现1C8和PD-1联合使用后小鼠荷瘤大小显著降低,也能有效下调TME中的CD8+T细胞的比例和巨噬细胞的比例。这表明SRSF10可能作为一种潜在的调节巨噬细胞并恢复抗肿瘤能力的方式。
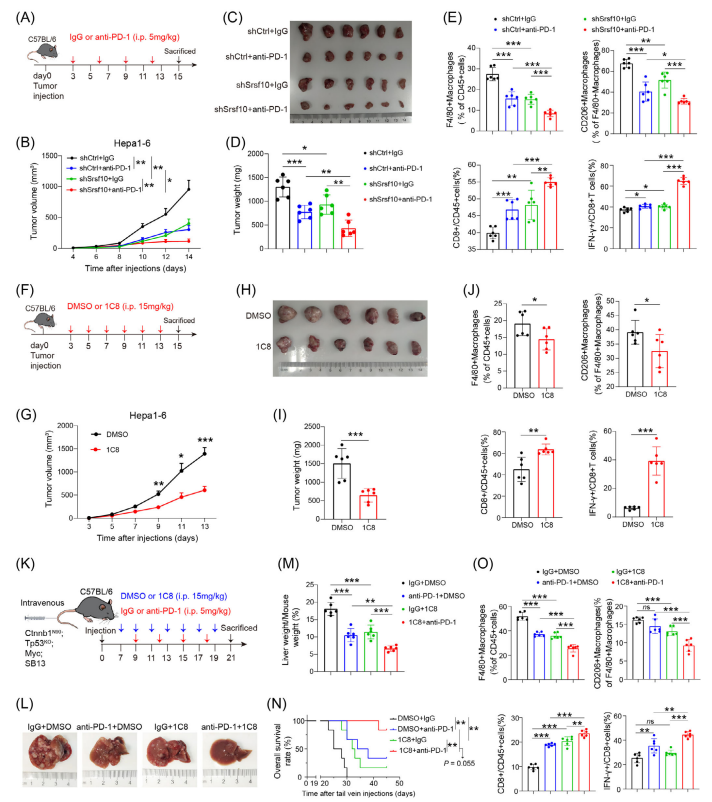
图6: shSRSF10或1C8抑制阻碍了HCC的肿瘤进展并增强了免疫治疗反应
7.SRSF10与免疫疗法的耐药性及不良预后密切相关

为了确定1C8是否能够在人体内重塑肿瘤微环境,研究者对PDOTS进行体外表征,1C8和PD-1的联合使用显著减少了M2型巨噬细胞的比例,并增加了CD8+ T细胞的浸润,IFN-γ和PRF1的分泌显著增加(图7C)。这表明联合治疗可能有助于改善免疫微环境并提高免疫治疗的效果。通过对TCGA数据库的单变量和多变量Cox回归分析以及对正常组织和肿瘤组织的免疫组化染色分析,发现低表达SRSF10的患者显示出更长的总生存期和更好的预后。研究人员还分析了接受PD-1单克隆抗体治疗的患者公开的单细胞RNA测序队列(GSE123813),结果表明非应答患者的肿瘤细胞中SRSF10表达更高,而GLUT1、HK1和LDHA等与糖酵解相关的基因也显示出与SRSF10相似的表达模式。
这些发现共同证实了SRSF10的表达与免疫治疗反应和患者生存期相关,表明SRSF10在HCC中的过表达是促进糖酵解和通过MYB激活的关键因素。SRSF10/糖酵解/H3K18la形成了一个正反馈循环,导致乳酸在肿瘤微环境中积累,进而通过诱导组蛋白乳酸化修饰,促进了促肿瘤的巨噬细胞极化,形成了免疫抑制的肿瘤微环境。

图7:SRSF10与免疫治疗耐药性和预后不良相关

总结
本研究揭示了SRSF10在肝细胞癌(HCC)中的重要作用,其中SRSF10通过促进糖酵解和调控肿瘤微环境中的免疫反应,对HCC的进展和免疫治疗的效果产生显著影响。研究显示SRSF10的高表达与HCC患者的不良预后和对免疫检查点抑制剂治疗的抗性密切相关。具体地,SRSF10能够与MYB mRNA的3'非翻译区相互作用,增强MYB RNA的稳定性,进而激活糖酵解相关基因的表达,导致乳酸积累,并通过诱导组蛋白乳酸化促进M2型巨噬细胞的极化,抑制CD8+ T细胞活性,形成免疫抑制的肿瘤微环境。此外,通过使用SRSF10的选择性抑制剂1C8,可以增强PD-1治疗的效果,表明抑制SRSF10可能成为克服HCC中PD-1治疗抵抗的有效策略。这些发现为HCC的免疫治疗提供了新的潜在靶点,并可能有助于开发新的治疗策略以提高免疫治疗的效果。
和元助力
和元生物有幸为研究者提供实验中使用的慢病毒(LV-shSRSF10,LV-shSrsf10 , LV- shMYB, LV-shMyb),以实际行动助力基础科学研究。
参考文献
[1] Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med. 2012;366(26):2443-2454
[2] Brahmer JR, Drake CG, Wollner I, et al. Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immunologic correlates. J Clin Oncol. 2010;28(19):3167-3175
[3] Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 2015 Mar 9;27(3):450-61. doi: 10.1016/j.ccell.2015.02.001. Epub 2015 Mar 10. PMID: 25747949; PMCID: PMC4365234.
























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论