自身免疫疾病(autoimmune diseases,AIDs)的特征是免疫耐受的破坏、自身反应性B细胞克隆的产生以及自身抗体的产生,导致多器官损伤。虽然AIDs的临床表现,如系统性红斑狼疮(SLE)、系统性硬化症(SSc)和类风湿性关节炎(RA),各不相同,但它们的病理生理机制都是由B细胞介导。因此,靶向B细胞是治疗AIDs的重要手段,这是清除B细胞的单克隆抗体(如利妥昔单抗[RTX])广泛应用于治疗AIDs的原因。然而,RTX在AIDs中很少诱导无药缓解(drug-free remission),在一些研究中甚至未能完全清除B细胞。尽管RTX有效地清除了外周血中的B细胞,但在实体组织和器官中很难耗尽B细胞,这体现在接受RTX治疗的患者中取得的滑膜组织、扁桃体、骨髓和淋巴结活检显示组织中B细胞的持续存在,表明RTX无法深层清除B细胞。靶向CD19-嵌合抗原受体(CAR)T细胞治疗已显示出在SLE和其他AIDs患者中诱导长期无药缓解的能力,如特发性炎症性肌病和重症肌无力。
人们推测,在AIDs中,CD19-CAR T细胞诱导的长期无药缓解是基于组织和次级淋巴器官中B细胞的深度清除。然而,尽管有动物实验数据和患者外周血的结果,但迄今为止有关人类组织中B细胞被清除的数据尚缺乏。
2024年8月,《Annals of the Rheumatic Diseases》杂志最新发布了一篇题为“CD19-CAR T-cell therapy induces deep tissue depletion of B cells”的文章。该文章展示了接受CD19-CAR T细胞治疗的AIDs患者,次级淋巴器官中B细胞被清除的情况。该文研究人员对患者进行了腹股沟淋巴结活检,总共分析了八名接受CD19-CAR T细胞治疗的患者(六名SLE和两名SSc)。他们在五名患者(三名SLE和两名SSc)中连续进行了活检,活检在CD19-CAR T细胞治疗前(清淋前)和细胞治疗后(在B细胞重新出现之前;在CD19-CAR T细胞输注后平均60.8天);从基线时腹股沟淋巴结和随访时的同侧(homolateral)区域进行,随访时的位置是根据前一次活检期间识别的部位形态(topographic)和超声标志确定的。他们对另外三名接受细胞治疗的SLE患者采集了非淋巴组织来分析。研究人员将CD19-CAR T细胞治疗患者的淋巴结活检与五名接受RTX治疗的AID患者(两名SSc和三名肉芽肿性多血管炎)的淋巴结活检进行了比较,这些患者在RTX治疗开始后平均98天进行了活检,活检时外周血不存在B细胞。CD19-CAR T细胞治疗后组织B细胞完全被清除
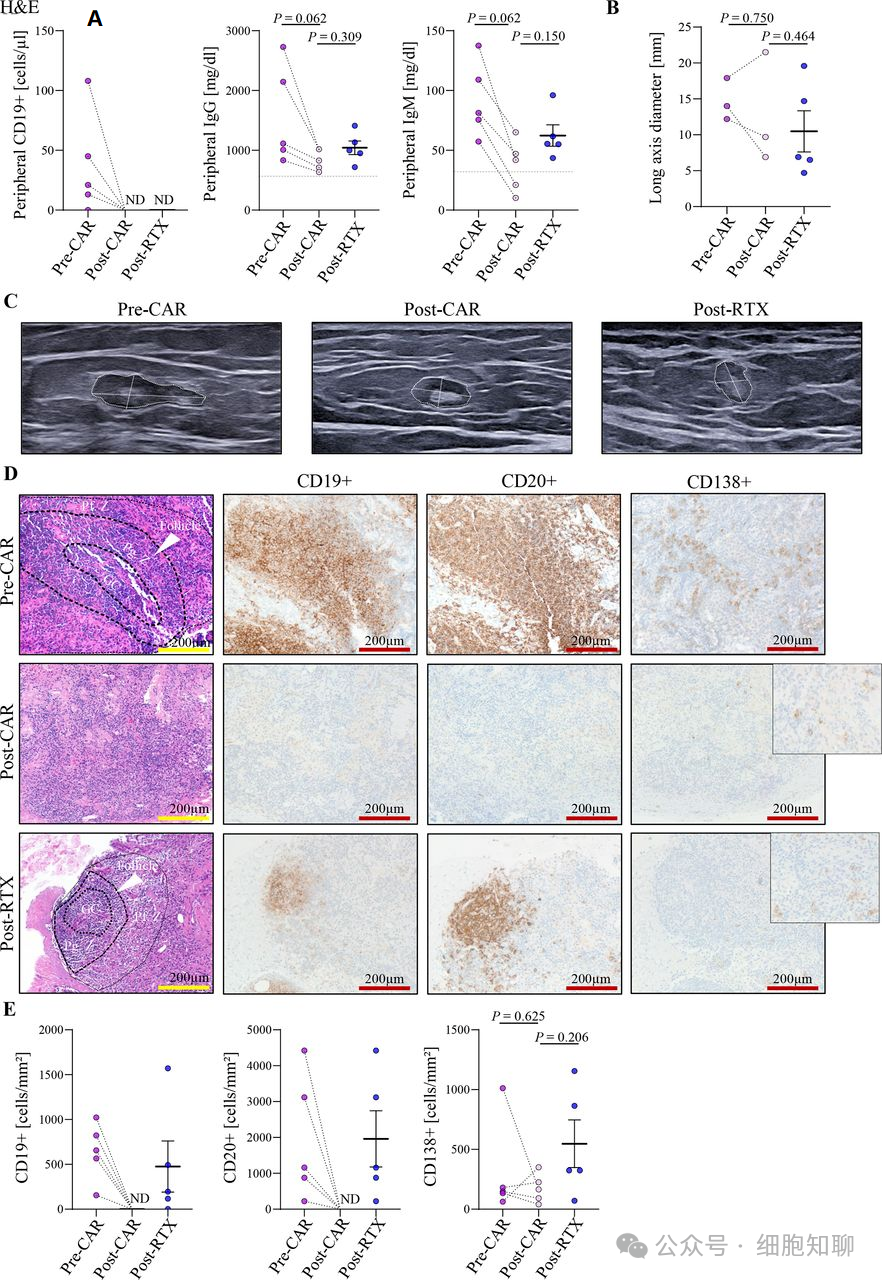
研究人员先展示了CD19-CAR T细胞治疗后外周血B细胞消失和免疫球蛋白(Ig)的减少与RTX的相似(图1A)。然后,他们通过超声评估腹股沟淋巴结的宏观尺寸(图1B、C)。结果显示,CD19-CAR T细胞治疗后的淋巴结尺寸与RTX的接近。随后,研究人员对腹股沟淋巴结活检中B细胞滤泡区域进行IHC染色微观评估,这些B细胞靠近滤泡树突细胞(follicular dendritic cells,FDCs)和滤泡辅助T细胞(follicular T helper cells,TFH)。CD19-CAR T细胞治疗后的患者淋巴结中CD19+和CD20+ B细胞完全被清除;在RTX治疗后CD19+和CD20+ B细胞持续存在(图1D、E)。在CD19-CAR T细胞治疗和RTX治疗后,淋巴结中仍可见一些常见的浆母细胞/浆细胞标记CD138+的细胞(图1D、E)。与RTX治疗相比,CAR T细胞治疗后浆细胞的增殖率较低。在CAR T细胞输注后的结肠、肾脏和胆囊标本中未发现B细胞,而存在T细胞和巨噬细胞,这提示非淋巴器官/组织中的B细胞被耗尽。▲图1: CD19-CAR T细胞治疗前后外周血和淋巴结的变化。(A) CD19-CAR T细胞治疗前(pre-CAR)和治疗后(post-CAR)以及RTX治疗后(post-RTX)的外周血CD19+ B细胞和免疫球蛋白水平。
(Β) 在活检过程中淋巴结长轴直径的评估定量。
(C) CD19-CAR T细胞治疗前后(左侧,治疗前CAR;中间,治疗后CAR)以及RTX治疗后(右侧,治疗后RTX)的腹股沟淋巴结的代表性超声图像。
(D) CAR治疗前和CAR治疗后患者以及RTX治疗后患者的淋巴结活检的代表性H&E染色图和免疫组化图。染色细胞为CD19+ B细胞、CD20+ B细胞和CD138+浆细胞。白色箭头指示淋巴结组织中的滤泡B细胞区域。
(Ε) CAR治疗前和CAR治疗后患者以及RTX治疗后患者的淋巴结中CD19+ B细胞、CD20+ B细胞和CD138+浆细胞的定量。
GC,生发中心;ND,不可检测;Pf. Z,外周滤泡区(perifollicular zone);Pg. Z,外周生发区(perigerminal zone)。CD19-CAR T细胞治疗后淋巴结滤泡结构的消失
接下来,研究人员利用包括FDCs、TFH细胞和滤泡中的增殖率(图2A)等测量参数,构建了一个综合的B细胞区室结构评分(图2B、C),旨在评估治疗后淋巴结滤泡结构的变化。在RTX治疗的患者中,FDC网和TFH细胞大多未改变,伴随着生发中心增殖率正常(>90%)或略微降低。相比之下,虽然在CD19-CAR T细胞状态前结构正常,但在细胞治疗后,B细胞成熟区室不复存在,包括FDC网和TFH细胞的消失以及增殖率的降低(<90%)。在淋巴结B细胞区室中的这些变化并未影响T细胞和巨噬细胞的分布,这些细胞在CD19-CAR T细胞治疗后保持稳定(图2D、E)。此外,在细胞治疗和RTX治疗的患者之间未发现巨噬细胞的差异。总体上,RTX组的T细胞数量高于治疗前和治疗后的细胞治疗组。(Α) CD19-CAR T细胞治疗前和治疗后以及RTX治疗后的淋巴滤泡/生发中心的代表性H&E染色图与免疫组化图,包括CD23+ FDCs、PD-1+ TFH和生发中心的Ki67+增殖细胞。
(Β) FDC评分、生发中心增殖评分(GC增殖评分)和TFH评分的热图评分。
(C) 汇总了FDC、GC增殖和TFH评分的综合B细胞区室结构评分。
(D) CD19-CAR T细胞治疗前和治疗后以及RTX治疗后的淋巴结活检中CD3+ T细胞和CD68+巨噬细胞的代表性免疫组化图。
(E) CD19-CAR T细胞治疗前和治疗后以及RTX治疗后的淋巴结中CD3+ T细胞和CD68+巨噬细胞的定量。
GC,生发中心;Pf. Z,外周滤泡区(perifollicular zone);Pg. Z,外周生发区(perigerminal zone)。
该研究揭示了基于抗体和基于细胞的治疗方式在深层清除细胞上的根本差异。
超声引导的淋巴结活检先前已在AIDs(RA)中使用,安全、耐受良好且有用,旨在研究患者的淋巴结组成。在RTX治疗后30天进行的组织分析表明,尽管外周血中显示B细胞完全消失,但淋巴结中的不一定被完全清除。该研究与这些先前的报告一致,在RTX治疗平均98天后,未观察到淋巴结中B细胞的完全消失。循环B细胞通常在接触RTX后84至224天之间重新出现。
迄今为止,只有一篇关于肾脏移植患者接受Obinutuzumab(抗CD20单克隆抗体)的报道表明,治疗后淋巴结中实现了良好但不完全的B细胞清除。双特异性T细胞engager,如blinatumomab,也诱导外周B细胞消除,在肝转移的癌症患者和RA患者的滑膜(synovial)组织中减少B细胞,但不彻底。该研究提示,CD19-CAR T细胞治疗的效果不仅局限于B细胞,还影响了FDCs。一种可能是,FDCs表达CD19,可能被CD19-CAR T细胞识别。另一种可能是,起源于间充质的FDCs并不真正表达CD19,而是通过一种称为trogocytosis的过程从B细胞中摄取它。关于体内次级淋巴器官的发育研究显示,B细胞是首先定植淋巴组织,然后FDCs出现。事实上,B细胞的存在对于FDCs的发展至关重要,并且已被证明依赖于淋巴毒素-β信号。在CD19-CAR T细胞治疗后患者淋巴结的重置(repopulation)也可能以类似的方式而不依赖于FDCs的情况下发生。到目前为止,没有数据显示RTX对FDCs有影响,这可以用RTX无法在次级淋巴器官中完全清除B细胞来解释。同样,B细胞对于TFH存活至关重要,B细胞在体内的被清除导致TFH的改变。其他免疫细胞(如T细胞和巨噬细胞)的数量未受到CD19-CAR T细胞治疗的影响,这与清淋治疗的主要作用有悖。清淋治疗影响B细胞和T细胞群体以及循环中的巨噬细胞,包括骨髓和其他组织中的巨噬细胞,没有特异性。在该项研究中,组织中其他免疫细胞的持续存在也表明,清淋不太可能是FDCs和TFH消失的原因,它们的消失很可能与缺乏来自B细胞的生存信号有关。该文研究人员还发现,CD19-CD138+浆细胞在淋巴结中未受到CD19-CAR T细胞治疗的影响,而CD19+CD138+浆母细胞被完全清除。这些数据表明,在CD19-CAR T细胞治疗后淋巴结中检测到的CD138+细胞处于最终分化阶段,成为浆细胞。在RTX治疗的患者淋巴结中也检测到浆细胞的持续存在,并且这些患者中没有一个出现低丙种球蛋白血症。然而,它们的增殖率明显比CD19-CAR T细胞治疗的高。全面表征浆细胞区室将需要分析骨髓活检,这些活检在当前患者队列中尚未获得。总之,在AIDs中,CD19-CAR T细胞可完全清除组织中的B细胞,并伴随着淋巴结中FDCs和滤泡结构的消失,可能的原因如下:(1) 抗原结合和效应功能整合到同一个细胞中,(2) CD19-CAR T细胞迁移到身体的任何组织,以及(3) 它们具有连续杀死B细胞的潜力。此外,与CD19-CAR T细胞与清淋治疗联合可完全清除淋巴结中的B细胞——这一效果在使用基于抗体的B细胞清除疗法时未曾观察到。
[1] Tur C, Eckstein M, Velden J, et al. CD19-CAR T-cell therapy induces deep tissue depletion of B cells. Ann Rheum Dis. 2024 Aug 17:ard-2024-226142.
关注博生吉细胞研究,获取免疫细胞治疗最新资讯。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论