
信使 RNA(mRNA)作为一类新兴药物,因其优异的可编程性和安全性被广泛应用于疫苗,肿瘤免疫疗法,基因治疗和蛋白质替代疗法等重要研究领域。传统 mRNA 药物往往具有较短的半衰期和有限的蛋白生产能力,这限制了 mRNA 药物在具有更高治疗阈值疗法(例如蛋白替代疗法)中的有效性。
王潇团队近年来致力于发展下一代 mRNA 设计及优化方法,课题组过去曾通过结合寡聚核糖核酸化学合成和 mRNA 酶合成方法,可控地在线性 mRNA 3′ 端引入化学和拓扑学修饰以提高其功能稳定性,而翻译效率则是 mRNA 药物有效性的另一维度。
翻译起始是 mRNA 指导蛋白合成的限速步骤,在这一过程中,真核翻译起始因子(eIFs)通过与 mRNA 的 N7 - 甲基 - 鸟嘌呤(m7G)帽结构相互作用进一步招募细胞质中的核糖体等内源蛋白翻译机器,从而开启 mRNA 翻译。
此前有大量研究表明,mRNA 帽以及 5′ 非翻译区域的化学修饰对于 mRNA 翻译及稳定性具有重要调控作用并展现出了改善治疗性 mRNA 药物性质的巨大潜力。尽管如此,现有基于 RNA 聚合酶的 mRNA 合成技术由于受到 RNA 合成酶结构兼容性的限制,难以引入更为多样化的 mRNA 化学或拓扑结构的修饰。
与此同时,具有外切酶抗性的环状 RNA(circRNA)作为更稳定的治疗性蛋白表达载体近年来也收到了广泛关注。然而,环状 RNA 依赖于由内部核糖体进入位点(IRES)驱动的蛋白翻译效率远低于经典 mRNA 帽依赖的翻译,导致环状 RNA 的蛋白表达能力较低。因此,通过环状 RNA 拓扑结构改造引入帽结构有望在保持环状 RNA 稳定性的同时提高其翻译效率。
2024 年 9 月 23 日,麻省理工学院化学系 / 博德研究所王潇课题组(博士生陈泓宇、刘当亮和 Abhishek Aditham 博士为论文共同第一作者)在 Nature Biotechnology 期刊发表了题为:Chemical and topological design of multicapped mRNA and capped circular mRNA to augment translation 的研究论文。
该研究通过基于连接的 mRNA - 寡聚核苷酸组装策略(RNA LEGO),利用化学酶法实现了汇聚式 mRNA 模块化组装,在更大的化学空间上探索了 mRNA 5′ 和 3′ 以及环状 RNA 化学修饰和拓扑结构改造,大幅提高了 mRNA 在细胞与小鼠体内的蛋白生产能力,为 mRNA 翻译起始机制及相关化学修饰设计提供了新见解。
为了实现对 mRNA 及环状 RNA 的化学修饰及拓扑结构改造,王潇课题组提出基于多种连接酶的 mRNA - 寡聚核苷酸组装策略(RNA LEGO),利用化学酶法实现了汇聚式 mRNA 模块化组装。
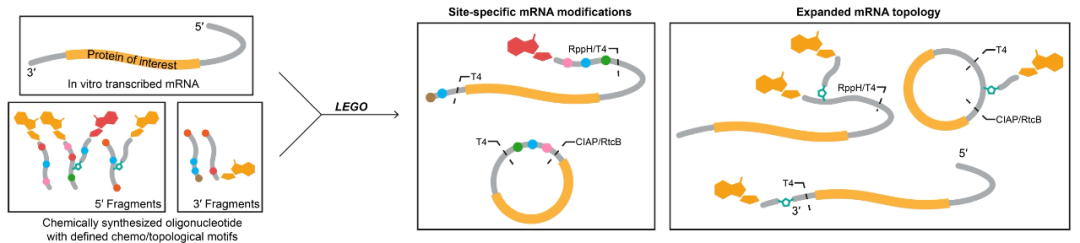
图1 | LEGO,一种位点特异性对 mRNA / circRNA 进行化学 / 拓扑修饰的策略
首先,通过化学加帽法及反向高效液相色谱,研究团队利用 RNA LEGO 策略合成并筛选了 mRNA 帽以及 5′ 非翻译区域的多种天然或非天然化学修饰,并通过组合多种单一有效的化学修饰成功将荧光素酶报告 mRNA 的蛋白表达提高了近 10 倍。同时,基于事实上 eIF 在结合 5′ 帽后,翻译起始复合体的组装完全依赖于蛋白-蛋白相互作用,课题团队认为在 5′ 非翻译区域引入非天然链接结构可能能被翻译起始机制兼容;与此同时,受团队先前多尾 RNA 工作的启发,他们推论在 5′ 端引入多个帽结构以增加 mRNA-eIF 的结合位点可能加速翻译起始复合体的形成。
基于这些假设,研究团队结合化学加帽反应和点击化学组装策略构建了含有双帽结构的枝状寡聚核苷酸,并通过 T4 连接酶引入 mRNA 的 5′ 末端,形成多帽 mRNA,并发现其可以提高 mRNA 的蛋白表达。通过对多帽 mRNA 拓扑结构的改造优化,研究者确定了最佳的主链及支链长度,从而实现 mRNA 蛋白表达水平的最大化。最终,结合 mRNA 5′ 化学修饰、双帽拓扑结构改造以及该课题组前期发展的 mRNA 3′ 化学修饰策略,研究者将荧光素酶报告 mRNA 的峰值蛋白表达水平提高了近 20 倍。
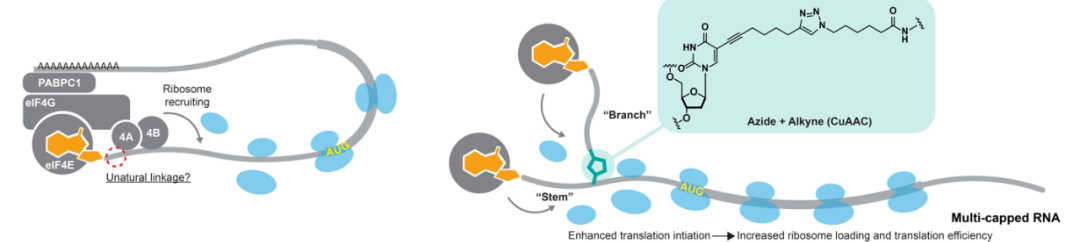
图2 | 多帽 mRNA 的设计思路
为了研究优化后帽及邻近的化学 / 拓扑修饰增强翻译的机制,研究团队首先应用连接有含帽的寡多聚核糖核酸磁珠及同位素标记定量蛋白沉降质谱对可能的作用蛋白进行了全局表征。他们观察到包括帽结合蛋白 eIF4E1(13 倍)及其他翻译相关蛋白如 eIF4G1(42 倍),eIF4G3(28 倍),eIF4A(6 倍)的显著富集。除此之外,化学修饰只增强了翻译相关帽结合蛋白 eIF4E1 的富集,而对其余翻译不相关的帽结合蛋白如 NCBP1 的富集却下降了 33 倍,显示化学修饰对翻译相关机制的选择性。
通过电泳迁移率检测实验,研究团队在体外用提纯蛋白确认了优化后的化学修饰或多帽结构能增强 eIF4E1 的结合,并且更显著的是,化学修饰也提高了帽 - eIF4E - eIF4G 共聚物的总体稳定性。除了结合翻译起始蛋白,帽结构同时也具有保护 mRNA 从 5′ 端被外切酶降解的作用,这一过程被脱帽蛋白 hDcp2 调控。在这一方面,研究团队发现,除了对帽本身的修饰,对 5′ 非翻译区的化学修饰显著增强了 mRNA 对脱帽酶的抗性,最优修饰的 mRNA 在体外脱帽酶 6 小时的作用下仅被脱帽 30%,而天然的帽 0 / 1 结构在同样条件下 15 分钟内就被完全脱帽。最后,通过研究团队自主发明的空间转录 / 翻译组技术 STARmap 和 RIBOmap,他们发现双帽 mRNA 在细胞内显著增加了核糖体结合的 mRNA 比例,验证了化学修饰及双帽结构双帽结构通过提高 mRNA 与翻译起始因子 eIF4E 的相互作用提高翻译起始速率进而提高翻译效率。

图3 | 含帽的环状 RNA 的设计思路
接下来,利用 RNA LEGO 的汇聚式合成策略,研究团队通过结合 T4 RNA 连接酶和 RtcB 连接酶介导的连接反应构建了一种不依赖于内含子的环状 RNA 环化及位点特异性修饰方法,首次合成了带有枝状帽结构的环状 RNA 并命名为 ——QRNA。结合对枝状 mRNA 帽结构的化学修饰,研究团队证明了环状 RNA 利用帽依赖机制进行翻译的可行性,并在体外和体内实现了对环状 RNA 翻译效率的大幅提高。通过对多种具有不同拓扑结构 RNA 翻译的研究,研究团队提出了 “帽临近驱动的翻译” 模型:当 5′ 帽以及非翻译序列通过天然磷酸二酯键、非天然共价或非共价互补配对等方式与 mRNA 相互作用时,在 mRNA 蛋白编码区附近的帽结构便可以招募核糖体并以 “插入(slot-in)” 的模式着陆于帽结构下游或上游约 20 碱基的 mRNA 编码区内并启动蛋白翻译。这一机制的揭示标明了 mRNA 翻译对各种不同拓扑结构的兼容性,并为后续的 mRNA 药物结构设计以及可能的天然 mRNA 翻译调控过程提供了新的启示。

图4 | 帽临近驱动翻译模型
最后,研究团队分别测试了该技术在 mRNA 疫苗和蛋白替代疗法中的治疗效果。结果表明, 相比于未修饰的 mRNA,经优化的编码人促红细胞生成素(hEPO)的双帽 mRNA - LNP 复合物能够在小鼠体内产生总共近 8 倍的 hEPO 蛋白表达并显著提高小鼠血液中网织红细胞的比例,显示其用于蛋白质疗法的优越性。而在针对 SARS - CoV - 2 的 mRNA 疫苗应用中,经优化的 mRNA 不仅能够在注射后七天内产生抗体免疫反应,而且在加强针免疫一周后产生 4 倍于未修饰 mRNA 组的抗体滴度。通过运用空间转录 / 翻译组学技术对小鼠淋巴的表征显示,优化后 mRNA 显著提高了抗原呈递细胞的激活程度;通过流式细胞术对小鼠脾细胞的表征,优化后 mRNA 疫苗显著增加了 T 细胞响应,这些结果表明了化学修饰和拓扑结构改造在提高 mRNA 治疗应用方面的潜力。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论