
使用到的RiboBio产品或服务
1. After the tumor was implanted subcutaneously, tumor-bearing mice were randomly divided into four groups, including LncRNA ASO (10 nmol per injection, RiboBio, China), control ASO, LncRNA ASO combined with oxaliplatin and 5-Fu, and control ASO combined with oxaliplatin and 5-Fu.
2. The FISH experiment was conducted using the Ribo Fluorescent In Situ Hybridization Kit (RiboBio, China) according to the manufacturer's instructions.
结直肠癌(CRC)是世界上最常见的恶性肿瘤之一。在过去的几十年里,抗癌药物(5-氟尿嘧啶或奥沙利铂作为一线药物)单药治疗或联合方案的应用显著延长了晚期CRC患者的生存时间。然而,化疗耐药的频繁发生对药物治疗造成了很大的限制。这促使我们发现关键分子并阐明导致化疗耐药的潜在机制,以开发新的治疗策略。
通常,肿瘤细胞比正常细胞携带更多的活性氧(ROS)。然而,过量的ROS会导致大量脂质过氧化物的产生,从而导致脂质膜失调并导致细胞死亡,定义为铁死亡。化疗或放疗后,会产生大量ROS以帮助杀死癌细胞。在化疗耐药的癌细胞中,消除ROS或脂质过氧化物对于保护细胞免受铁死亡和获得耐药性至关重要。探索ROS平衡与癌症化疗耐药的协同机制将使我们对肿瘤治疗有更好的认识。
代谢改变对于肿瘤细胞平衡ROS的产生和消除至关重要。还原剂通常用于解毒ROS或脂质过氧化物,以保持细胞存活,例如谷胱甘肽(GSH)和还原烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NADPH)。GSH协助GPX4将脂质过氧化物转化为无毒的脂质醇,从而抑制铁死亡。细胞GSH的合成依赖于胱氨酸转运蛋白系统xc-(主要由SLC7A11组成),这对于GPX4介导的铁死亡预防至关重要。肿瘤抑制因子p53转录抑制SLC7A11的表达以启动铁死亡。最近,据报道p53还调节维生素K代谢并诱导铁死亡。VKORC1L1是产生还原型维生素K的关键酶,可减少脂质过氧化物并保护细胞免受铁死亡。p53的激活降低了VKORC1L1的表达,从而诱导癌细胞铁死亡以进行肿瘤抑制。这些研究表明,p53介导的代谢改变与肿瘤抑制有关。对于化疗耐药细胞,逃避p53相关的铁死亡对于获得对化疗的耐药性至关重要,化疗会产生多余的ROS和脂质过氧化物。然而,其潜在机制仍不清楚。
长链非编码RNAs(lncRNAs)是指长度超过200个核苷酸的非编码RNA转录本。近年来,大量研究报道lncRNAs与肿瘤发生和癌症进展(如癌细胞生长、转移和耐药性)密切相关。靶向lncRNA显示出开发癌症治疗新策略的潜力,例如通过小干扰RNA(siRNA)、反义寡核苷酸(ASO)或CRISPR/Cas9系统抑制lncRNAs。据报道,一些lncRNAs参与调节肿瘤代谢。然而,lncRNAs在调节p53介导的代谢适应以平衡CRC化疗后ROS水平中的作用仍不清楚。
近日,Redox Biology期刊发表LncRNA-HMG incites colorectal cancer cells to chemoresistance via repressing p53-mediated ferroptosis的研究论文。揭示了LncRNA-HMG通过抑制p53介导的铁死亡加重CRC化疗耐药的作用机制。这些发现突出了LncRNA-HMG在CRC化疗耐药中的关键作用,并暗示了其作为CRC治疗靶点的潜在价值。

首先,研究人员通过TCGA数据库分析以筛选CRC中铁死亡相关lncRNA。结果筛选出11个lncRNAs,并将LncRNA-HMG鉴定为结直肠癌(CRC)中化疗耐药相关的lncRNA。临床分析显示,LncRNA-HMG的异常高表达预示着CRC患者的预后较差。功能实验显示,LncRNA-HMG保护CRC细胞在化疗时免受铁死亡,从而增强CRC细胞的耐药性。

Fig1. LncRNA-HMG与CRC患者的预后相关
机制研究发现,LncRNA-HMG与p53结合并促进MDM2介导的p53降解。p53的降低诱导SLC7A11和VKORC1L1的上调,这有助于增加还原剂的供应,并消除过量的ROS。因此,CRC细胞从铁死亡中逃脱并获得化疗耐药性。重要的是,在患者来源的异种移植物(PDX)模型中,反义寡核苷酸(ASO)对LncRNA-HMG的抑制使CRC细胞对化疗显著敏感。LncRNA-HMG也是β-catenin/TCF的转录靶标,激活的Wnt信号可触发LncRNA-HMG的显著上调。
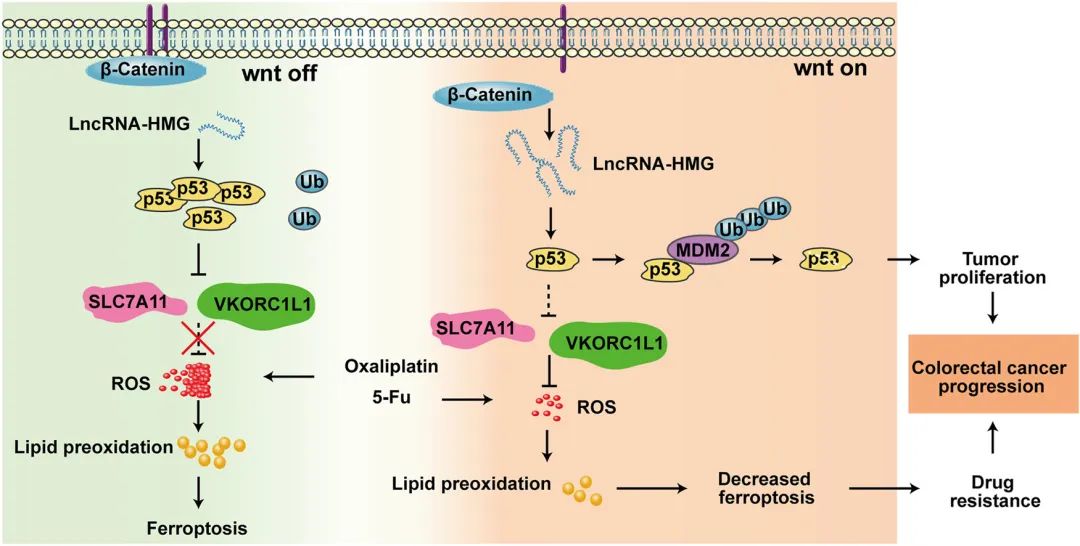
Fig2. LncRNA-HMG通过抑制铁死亡调节CRC化疗耐药的工作模型
总之,本研究结果表明LncRNA-HMG与CRC化疗耐药相关。Wnt信号上调LncRNA-HMG的表达。随后,LncRNA-HMG减弱p53介导的铁死亡,从而促进ROS或脂质过氧化物的消除。最后,LncRNA-HMG保护CRC细胞免受铁死亡。因此,LncRNA-HMG可能是CRC治疗的潜在靶点。
原文链接:
https://www.sciencedirect.com/science/article/pii/S2213231724003409#sec3




联系我们
电话:400 686 0075
邮箱:marketing@ribobio.com
官网:www.ribobio.com
点击 阅读原文 了解更多资讯!
























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论