
抗体药物的开发是一个复杂和漫长的过程,构建高表达稳定细胞株是抗体药工艺开发的起点和基础。三优生物的生产细胞株构建平台具备190+ 工业细胞株和3000+ 细胞株构建及鉴定的经验(图1和图2),具备4套商业化授权的宿主,依据600+ SOP,1200+ 国际先进仪器设备,10000+ m2,开放实验室,全程C+A级GMP环境,从而能够快速高效生产出合规的、高表达量的、高质量的、稳定性好的工业细胞株。
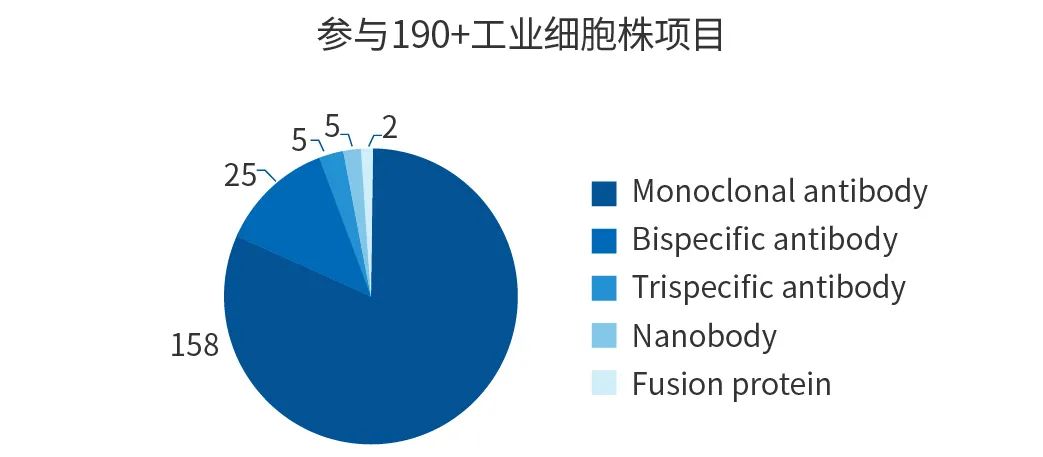
▲ 图1 生产工业细胞株项目数量
1. 稳定细胞株构建流程
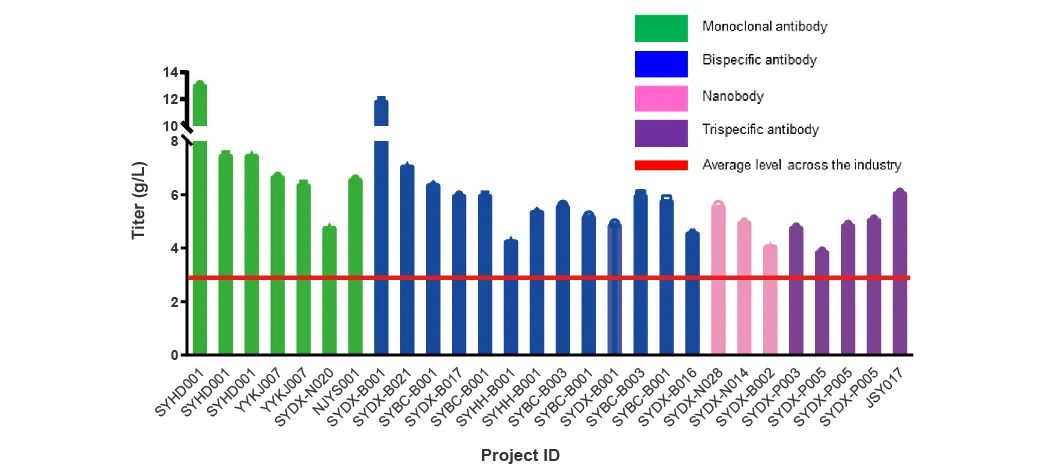
生产用细胞株构建平台提供4套授权细胞株供客户选择(包括Thermo授权的Freedom CHO-S, Horizon授权的HD-BioP3 Null CHO K1,Merck授权的CHOZN与QuaCell授权的CHO-K1Q),细胞株构建经过4重筛选体系,6轮筛选过程,2轮稳定性评估,为全球客户提供快速高效、合规、高表达量、高质量、稳定性良好的生产用细胞株。细胞株构建流程包括基因优化、载体构建、细胞转染、细胞池筛选、单细胞克隆及筛选、细胞库构建和稳定性评估(图3)。平台实行严格的cGMP管理体系,仅需约2.5个月即可获得稳定高表达的高质量细胞株,表达量最高可达13 g/L。
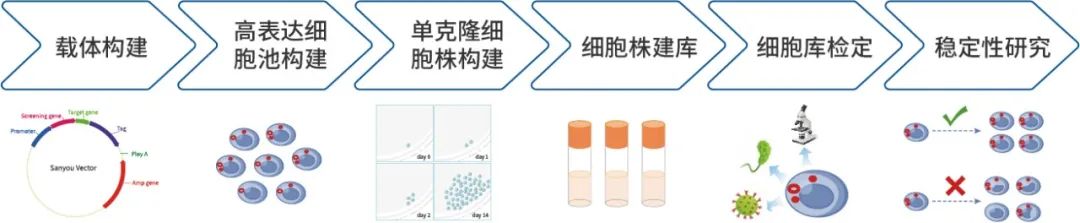
▲ 图3 单克隆细胞株构建总体概览图
2. 三优单克隆细胞株构建案例
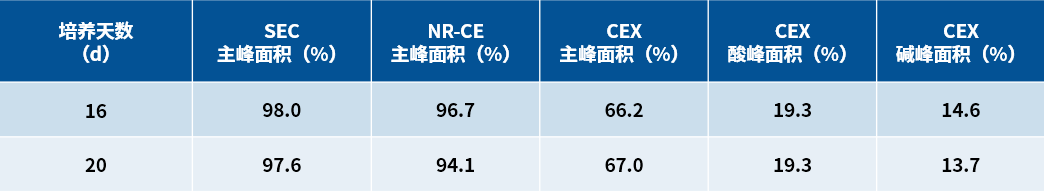
细胞株构建案例为IgG1单抗,细胞池构建工艺为Bulk pool,然后进行单克隆细胞株和稳定性筛选,3 L反应器筛选得到表达量高、稳定传代的细胞株,具体见下文。
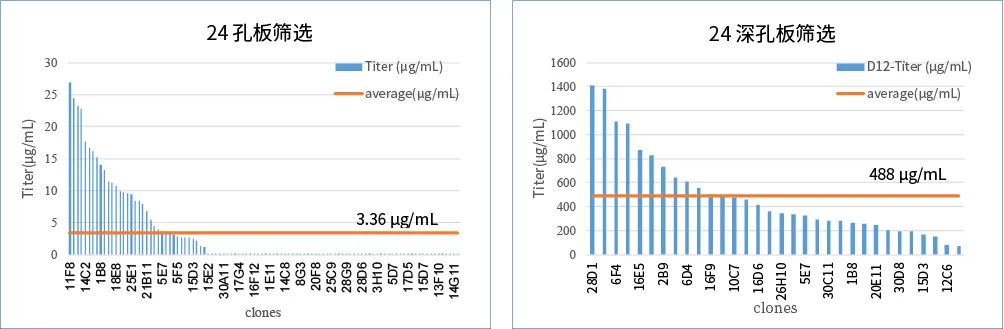
▶ 2.1. 高表达细胞池构建

▲ 图4 高表达细胞池的密度、活率及表达量
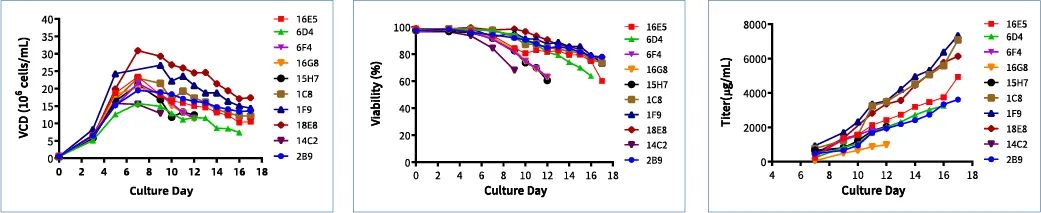
▲ 图6 F125摇瓶Fed-batch培养单克隆细胞的生长代谢数据
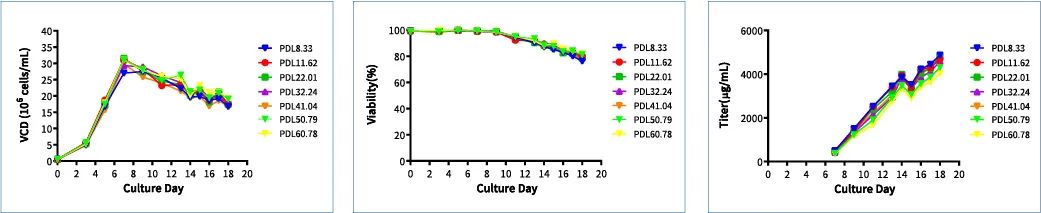
▲ 图7 单克隆A预稳定性培养细胞的生长代谢数据
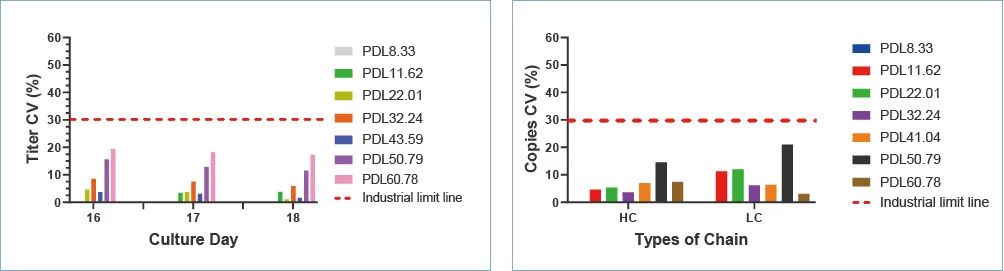
▲ 图8 单克隆A表达量和基因拷贝数的稳定性评估
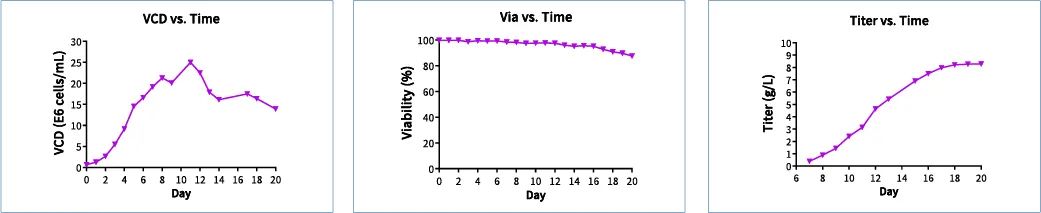
▲ 图9 3 L反应器中单克隆A的生长代谢数据
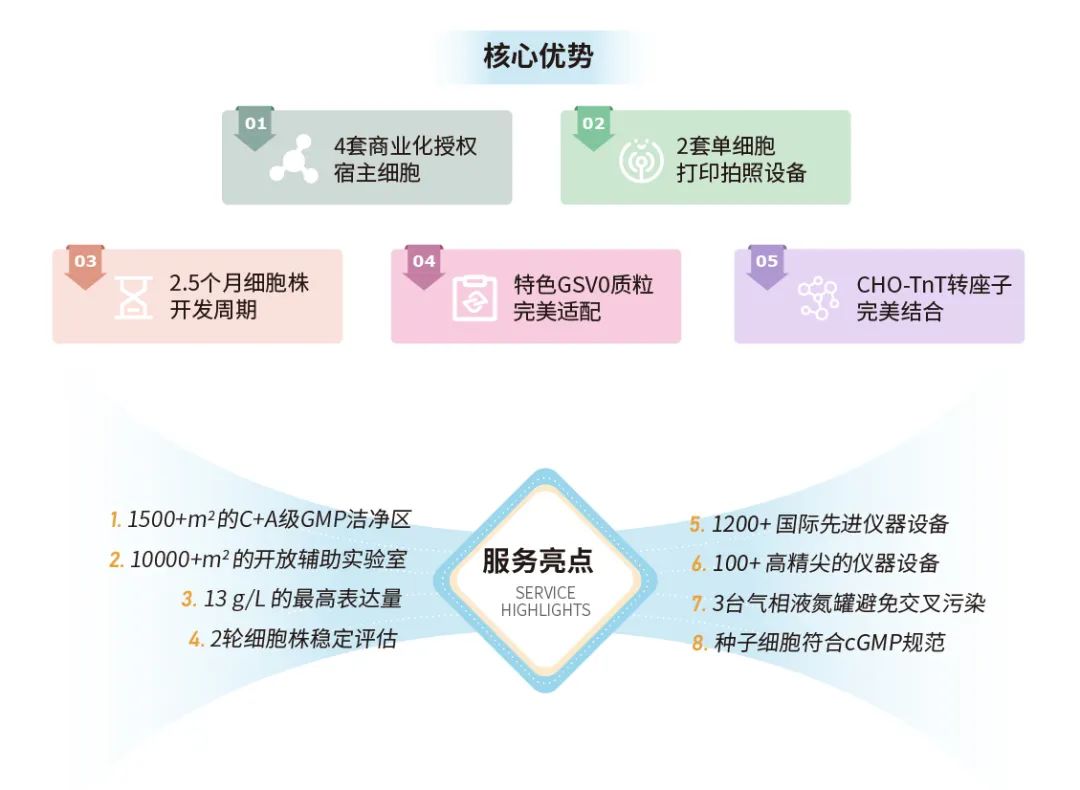
3. 三优细胞株构建优势和服务亮点
三优生物细胞株构建团队成员项目经验丰富,具有3000+ 细胞株构建及鉴定的经验,种类涵盖单抗、双特异性抗体、三特异性抗体、融合蛋白等。目前,引入4套商业化授权CHO细胞株,具有特色GSV0质粒完美适配宿主,引进CHO和TnT转座子完美结合技术,2套单克隆打印及成像系统提供双重保障,实行cGMP标准,最快仅需约2.5月即可获得稳定高表达的高质量细胞株,表达量最高可达13 g/L,稳定性传至PDL 60仍符合行业标准。
4. 总结
三优生物的历经近9年的发展,细胞株构建平台依据600+ SOP,1200+ 国际先进仪器设备,10000+ m2开放实验室,全程C+A级GMP环境,最快仅需约2.5月即可获得稳定高表达的高质量细胞株,表达量最高可达13 g/L,稳定性进行超过60个PDL的评估,旨在打造全球领先的生产细胞产业一体化服务。

▲ 公司外景


推荐阅读
▶ 喜讯|三优生物荣获2024 bioSeedin Awards
关于三优生物
三优生物成立于2015年,是一家国际领先的专注于创新生物药研发和服务的高新技术企业;公司致力于实现“让天下没有难做的创新生物药”的使命;公司建立了“差异化CRO、整合型CDO、协同型CPO、特色CRS”于一体的4C综合业务体系。
公司建立了设施设备先进齐全的创新生物药一体化研发实验室;公司发展起了一支以硕士和博士为主的专业团队;公司打造了居于行业领军水平的“超万亿、一体化、智能化”三大创新药研发技术平台;公司建立了以十万亿噬菌体展示分子库为代表的,涵盖原材料制备、分子发现、分子优化、体内外药效、细胞株构建、上下游工艺、临床前研发及产业化开发等的50多个技术子平台。
公司的业务网络已扩展至中美欧等世界各地,公司在波士顿、费城、圣地亚哥和伦敦等地设有业务网点;公司已和全球1000多家制药公司、药物研发机构、诊断试剂产品公司建立了友好的业务合作关系。公司已获得国家高新技术企业、专精特新、ISO9001质量管理体系、GB/T知识产权管理体系等认证。


你“在看”我吗?



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论