
转载自 中国医学论坛报今日肿瘤
前言
2024年欧洲肿瘤内科学会(ESMO)年会已于9月13~17日在西班牙巴塞罗那圆满落幕。会议期间,大会公布了众多可能对临床实践产生重大影响的研究数据,并促进多学科的深入讨论,以期改善患者的治疗方案选择。作为成功“出海”的代表性中国原研药,特瑞普利单抗多项研究在2024年ESMO年会中亮相,得到了多方关注。在肺癌领域,一项索凡替尼联合特瑞普利单抗、培美曲塞(A)和铂类(P)化疗用于晚期非鳞状非小细胞肺癌(nsq-NSCLC)患者的单中心、Ⅱ期研究的更新结果荣登壁报展示环节(#1345P)[1]。研究结果提示四药联合方案不受驱动基因突变状态的影响,具有令人鼓舞的抗肿瘤活性和可接受的安全性,尤其在无脑转移患者中获益更为明显,为晚期nsq-NSCLC的治疗提供了新的视角。在此背景下,特邀研究通讯作者,中山大学肿瘤防治中心张力教授接受专访,剖析nsq-NSCLC治疗现状,解读研究更新数据,分享非小细胞肺癌研究进展。

来源:ESMO官网
- 张力教授 -
中山大学肿瘤防治中心内科科主任导师、博士生导师、二级教授、肺癌首席专家
中国抗癌协会(CACA)癌症康复与姑息治疗专业委员会主任委员
中国抗癌协会(CACA)肿瘤药物临床研究专业委员会候任主任委员
中国临床肿瘤学会(CSCO)常务理事
中国临床肿瘤学会(CSCO)免疫治疗专家委员会候任主任委员
中国临床肿瘤学会(CSCO)非小细胞肺癌专家委员会副主任委员
中国临床肿瘤学会(CSCO)肿瘤支持与康复治疗专家委员会副主任委员
广东省医学会临床研究学分会主任委员
广东省临床医学会精准医学分会主任委员
- 方文峰教授 -
中山大学肿瘤防治中心主任医师、教授
中肿国家重点实验室PI、博士研究生导师
“国家高层次人才项目青年人才”
“广东省特支计划百千万工程青年拔尖人才”
“广东省杰出青年医学人才”
“广州市珠江科技新星”
CSCO非小细胞肺癌专业委员会委员
CSCO鼻咽癌专业委员会委员
中国抗癌协会肺癌专业委员会委员
广东省抗癌协会鼻咽癌专业青年委员会副主任委员
广东省医学会精准医学与分子诊断专业委员会副主任委员
广东省临床医学会真实世界临床研究专业委员会副主任委员
研究方向:肺癌及鼻咽癌的靶向治疗及免疫治疗的临床及转化研究
主要课题:主持国家重大研发计划(子课题)、国自然(6项)
代表论著:JAMA、Cancer Cell、JCO、Lancet Oncology(2篇,2021,2018)、STTT、Molecular Cancer、 Nature Communications、J Thorac Oncol、Clinical Cancer Research、JITC等
随着免疫治疗和靶向治疗的突破性进展,非小细胞肺癌的治疗格局已经发生了深刻变化。非鳞状非小细胞肺癌作为亚型之一,其治疗存在哪些尚未被满足的临床需求?
晚期nsq-NSCLC治疗面临挑战
免疫治疗联合靶向治疗强强合力
张力教授
中山大学肿瘤防治中心
在全球范围内,肺癌的新发病例数和死亡病例数均居于首位[2],对公共卫生构成了严峻的挑战。NSCLC是肺癌中最常见的病理组织学类型,约占85%[3],并可进一步细分为鳞状与非鳞状癌,其中nsq-NSCLC约占75%[4]。从分子特征来看,鳞状癌与非鳞状癌在基因异常方面存在显著差异。在非鳞状癌中,大约有50%的患者表现出驱动基因异常[5],这一现象使得非鳞状癌患者有机会接受相应的靶向药物治疗。然而,对于那些驱动基因阴性的患者而言,靶向治疗收效甚微。直到免疫检查点抑制剂(ICI)的快速发展,改变了NSCLC的治疗格局。作为特瑞普利单抗一线nsq-NSCLC适应证获批的重要基础,CHOICE-01研究结果显示[6],意向性治疗(ITT)人群中特瑞普利单抗+化疗组无进展生存期(PFS)和总生存期(OS)均显著优于安慰剂联合化疗组,为患者带来了更长的生存获益。为了提高免疫治疗获益人群的覆盖率,免疫联合治疗方案仍在不断创新。基于索凡替尼在NSCLC患者中作为三线或更后线治疗(NCT04922658)或与化疗联合用于一线治疗失败的NSCLC患者(ChiCTR2100047313)中显示出的优异疗效,特瑞普利单抗+索凡替尼+化疗四药联合治疗nsq-NSCLC的研究正式开展(NCT05003037)。
本次ESMO大会公布了该研究的更新结果,结果显示患者疾病控制率达95.4%,中位PFS达10.4个月,请您解读研究结果并分享研究亮点。
一线与后线齐飞,疗效与安全兼顾
特瑞普利单抗四联方案再展雄图
张力教授
中山大学肿瘤防治中心
NCT05003037研究是一项单中心、两队列、Ⅱ期研究(图1),其中队列1为无驱动基因突变的初治患者,队列2为既往接受酪氨酸激酶抑制剂(TKI)治疗失败的具有驱动基因突变的经治患者。在安全性导入期(队列1/队列2中分别观察到1/0例剂量限制性毒性)确定了剂量扩展阶段的适当剂量后,两队列患者均接受索凡替尼(简称S,250mg,qd)+特瑞普利单抗(简称T,240mg,q3w)+AP双药化疗(q3w)方案治疗,4周期后采用S+T+A(q3w)进行维持治疗。研究的主要终点是PFS,次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、OS以及安全性。此前,研究在2023年欧洲肿瘤内科学会免疫肿瘤大会(ESMO IO)公布的初步结果显示[7],无论nsq-NSCLC患者是否伴有驱动基因突变,该四药联合方案具有可观的抗肿瘤活性和良好的耐受性。
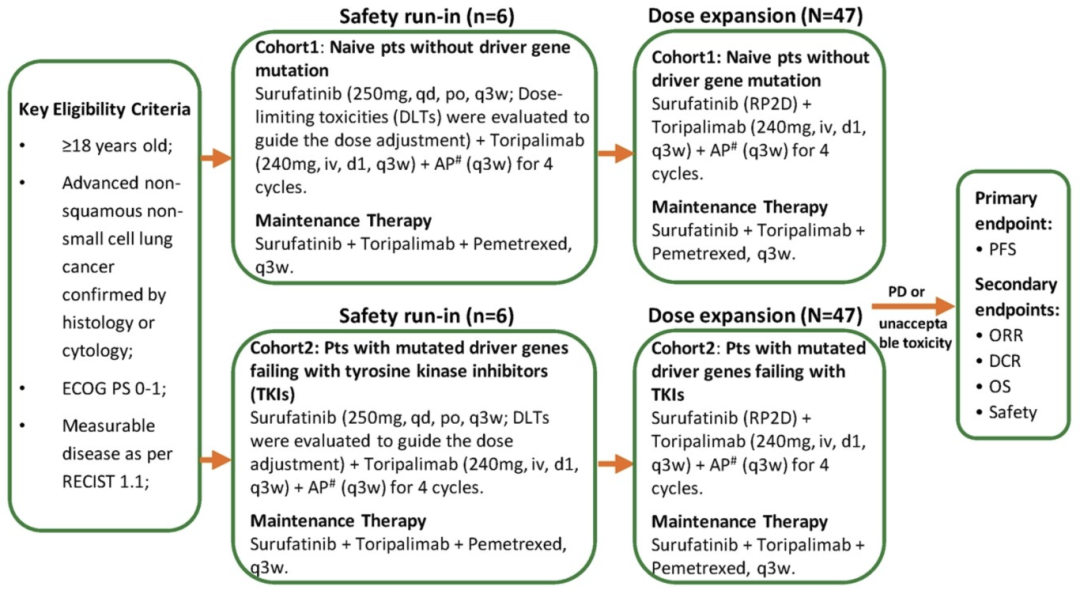
图1 研究设计
截至2024年7月15日,研究共纳入了78例患者。队列1中有47例患者,中位年龄为63岁(表1)。其中87.2%的患者为男性,所有患者均为Ⅳ期肺癌,48.9%的患者在基线时被确诊为伴有脑转移,89.4%的患者被诊断为肺腺癌。队列2中有31例患者,中位年龄为58岁,其中48.39%患者为男性,93.55%患者为Ⅳ期肺癌(表2)。队列2中最常见的突变基因是EGFR(58.06%)、HER2(12.90%)和BRAF/MET/RET(6.45%),最常用的TKI为奥希替尼(32%)、吉非替尼(19%)和阿美替尼(19%)。两个队列的患者招募仍在进行中。这种分组贴近临床实际,有助于评估不同治疗背景患者对联合疗法的反应。
表1(左) 队列1患者基线特征 表2(右) 队列2患者基线特征

高度缓解,大多数患者达到PR
在肿瘤缓解方面,队列1和队列2分别有43例患者和31例患者接受了至少1次基线后肿瘤评估。队列1中,25例部分缓解(PR),16例疾病稳定(SD),2例疾病进展(PD),ORR为58.13%,DCR为95.35%(图2左)。亚组分析显示,伴脑转移/无脑转移患者中ORR和DCR分别为54.55%/61.90%和90.91%/100%。队列2中,18例PR,11例SD,2例PD,ORR为58.06%,DCR为93.55%(图2右)。亚组分析显示,伴脑转移/无脑转移患者中ORR和DCR分别为50.00%/64.71%和85.71%/100%。优秀的ORR数据意味着四药联合方案的治疗有效,超过一半的患者在接受治疗后肿瘤有所缩小,且DCR数据表明,绝大多数患者的肿瘤体积得到了控制。尽管脑转移的存在对治疗效果有一定的影响,但仍显示出了四药联合方案的积极作用。


图2 队列1(左)、队列2(右)目标病变基线后最佳变化
长期生存,无脑转移患者获益更为显著
在生存获益方面,队列1(图3左)、队列2(图3右)的中位PFS分别为10.4个月(95%CI:3.5个月~17.3个月)和10.2个月(95%CI:6.6个月~13.7个月)。亚组分析中,无脑转移的患者在两个队列中均表现出更长的PFS:队列1的中位PFS为15.4月,比伴脑转移的患者长7.1个月(P=0.095);队列2的中位PFS未达到(伴脑转移患者的中位PFS为8.5个月),15个月PFS率为50.84%。虽然脑转移组间PFS差异尚未有统计学意义,但仍显示出了临床获益趋势。此外,微卫星稳定(MSS)的肿瘤通常被认为对ICI的反应不佳,但队列1中11例MSS患者的中位PFS达15.4个月。这一结果表明,联合治疗方案可能通过某种机制有效地提高了治疗敏感性,值得进一步研究。两队列的中位OS尚未达到。

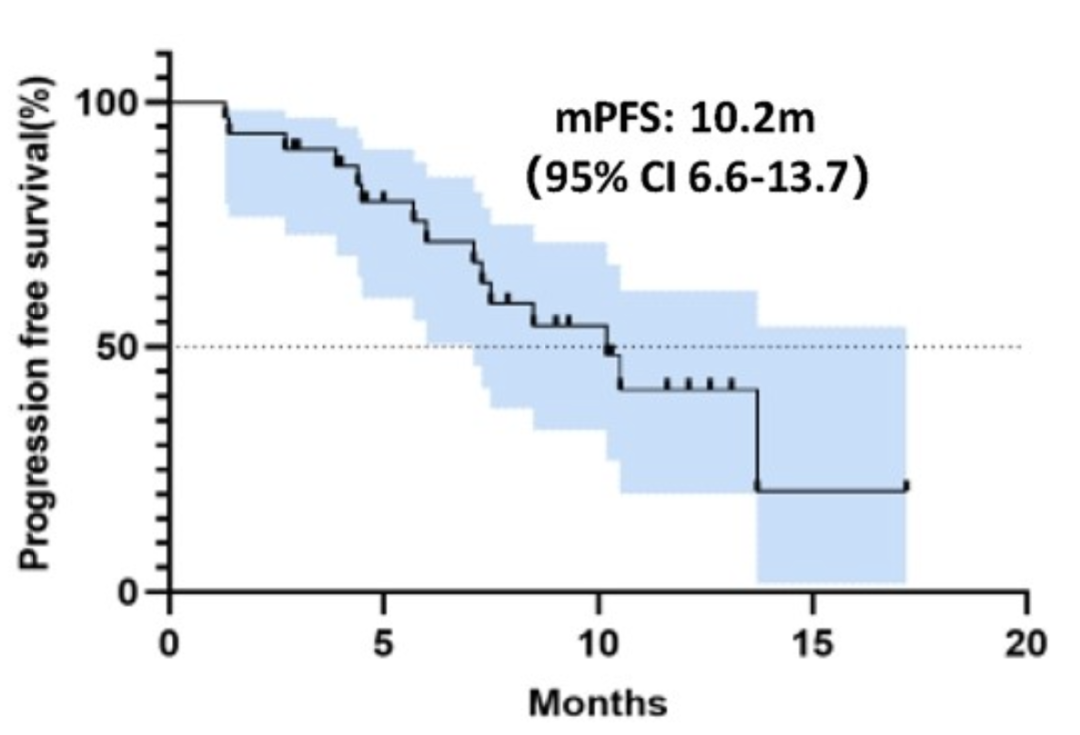
图3 队列1(左)、队列2(右)PFS生存曲线
安全可控,无明显安全性问题
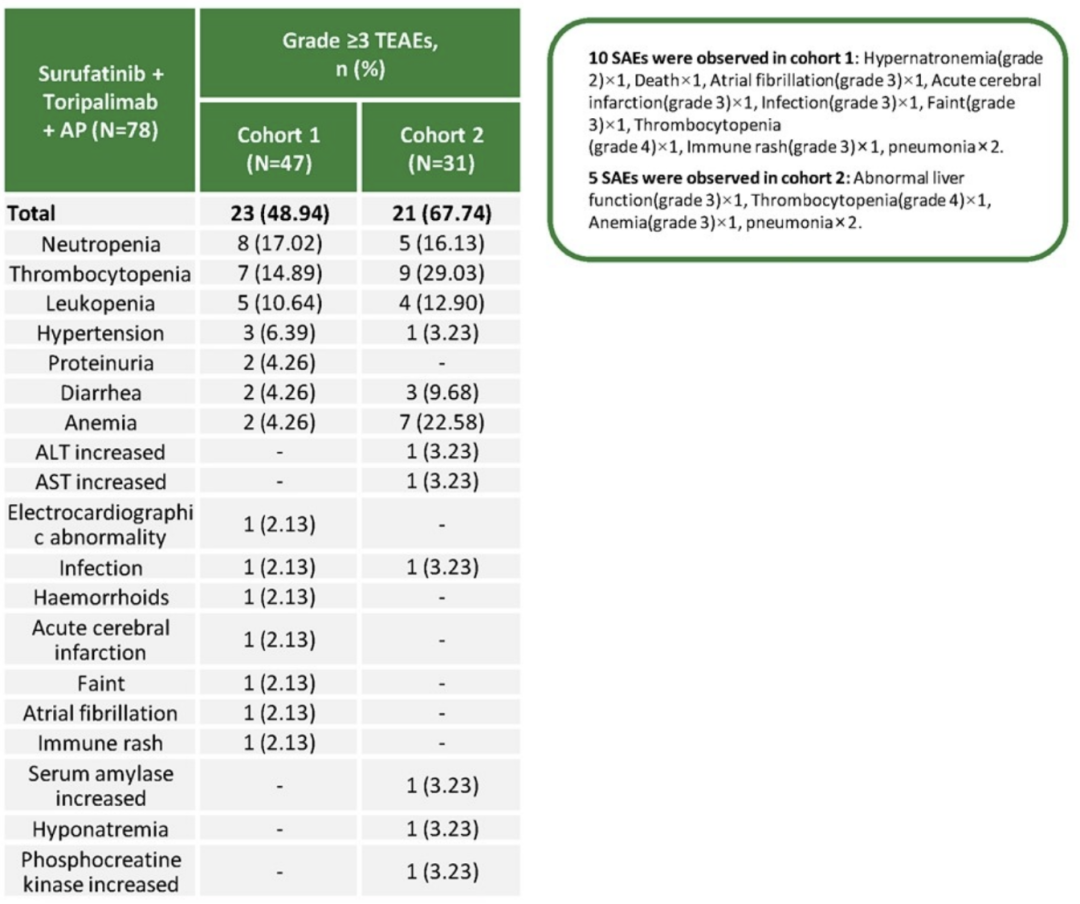
在安全性方面,所有患者均经历了至少1次治疗期间不良事件(TEAE)。关于≥3级TEAE(表3),队列1中最常见的是中性粒细胞减少(17.02%)、血小板减少(14.89%)和白细胞减少(10.64%),队列2中最常见的则为血小板减少(29.03%)、贫血(22.58%)和中性粒细胞减少(16.13%)。四药联合方案的安全性良好,未观察到新的安全性信号。
表3 ≥3级TEAE统计
研究证实,无论驱动基因是否发生突变,特瑞普利单抗联合索凡替尼及化疗药物的四药联合方案在nsq-NSCLC治疗中表现出令人鼓舞的抗肿瘤活性和可接受的安全性,特别是在无脑转移的患者中,获益更为显著,为晚期nsq-NSCLC患者提供了新的希望。
免疫治疗联合靶向治疗的方案已在肺癌领域中得到应用,请您谈谈该疗法在非小细胞肺癌中的研究现状。
靶免联合为肺癌患者提供新选择
免疫治疗代表性药物特瑞普利单抗发挥引领作用
张力教授
中山大学肿瘤防治中心
在一线治疗方面,特瑞普利单抗还有一项联合索凡替尼的“去化疗”理念治疗方案研究[9]。该研究是一项多中心、单臂、Ⅱ期研究,旨在评估特瑞普利单抗联合索凡替尼一线治疗PD-L1表达阳性的晚期NSCLC的疗效和安全性。研究结果显示,对于PD-L1表达阳性的晚期NSCLC患者,靶免联合方案具有一定的抗肿瘤作用,且安全性可控,尤其在PD-L1高表达人群中获益更为显著。而在后线治疗方面,基于ORIENT-31研究[10],已有一项靶免联合治疗方案获得了《2024 CSCO非小细胞肺癌诊疗指南》[11]中治疗晚期EGFR突变非小细胞肺癌的Ⅲ级推荐。研究结果显示,信迪利单抗+贝伐珠单抗+培美曲塞+顺铂四药联合方案可改善EGFR-TKI耐药后非小细胞肺癌患者的PFS,与信迪利单抗联合化疗或单独化疗相比,显著降低了疾病进展或死亡风险。还有一项双重免疫检查点抑制剂艾托组合抗体联合贝伐珠单抗及化疗的联合方案,也在DUBHE-L-201研究[12]中证实了其对EGFR-TKI耐药非小细胞肺癌患者的疗效。这些研究证明,免疫治疗与靶向治疗的结合应用,可以发挥各自的优势,提高NSCLC的治疗效果。
总体而言,作为免疫治疗的代表性药物,特瑞普利单抗联合靶向治疗已在多个相关研究中展现出了优异疗效,相信在未来的肺癌诊疗中,特瑞普利单抗能够继续深化其临床研究的布局,并持续探索创新的联合治疗方案,为患者提供更为全面和精准的治疗选项,全方位守护患者的健康,使中国原研创新药在国际舞台绽放更为璀璨的光芒。


声明
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论