
三阴性乳腺癌(TNBC)是一种高度异质性的疾病,多见于年轻女性群体,具有独特的病理、分子和临床特征,与其他亚型的乳腺癌相比,其患者生存率较低。
Y盒结合蛋白-1(YB-1)是一种原癌蛋白,通过其RNA结合特性来调控多种细胞过程,包括mRNA转录、DNA修复、RNA剪接、转录稳定性和生理及病理条件下的翻译调节。YB-1在癌症的发生与发展过程中扮演着重要的角色,其过表达与肿瘤的进展、细胞侵袭力增强及治疗抵抗性的出现紧密相关。在此前的研究中,研究人员开发了一种基于氟的鬼臼毒素衍生物——SU056,已在卵巢癌中被确定为一种高效的YB-1抑制剂,可抑制肿瘤进展并与化疗产生协同作用。
在此基础上,美国俄勒冈大学奈特癌症研究所的Arpit Dheeraj、Sanjay V. Malhotra 等人在《Cell Reports Medicine》上发表了一篇题为“Inhibition of protein translational machinery in triplenegative breast cancer as a promising therapeutic strategy”的研究论文。他们的研究表明,SU056作为YB-1的有效抑制剂,可通过干预关键致癌蛋白的翻译过程,从而显著减缓三阴性乳腺癌(TNBC)的进展,展现出作为三阴性乳腺癌治疗新策略的巨大潜力。

SU056抑制TNBC细胞的生长
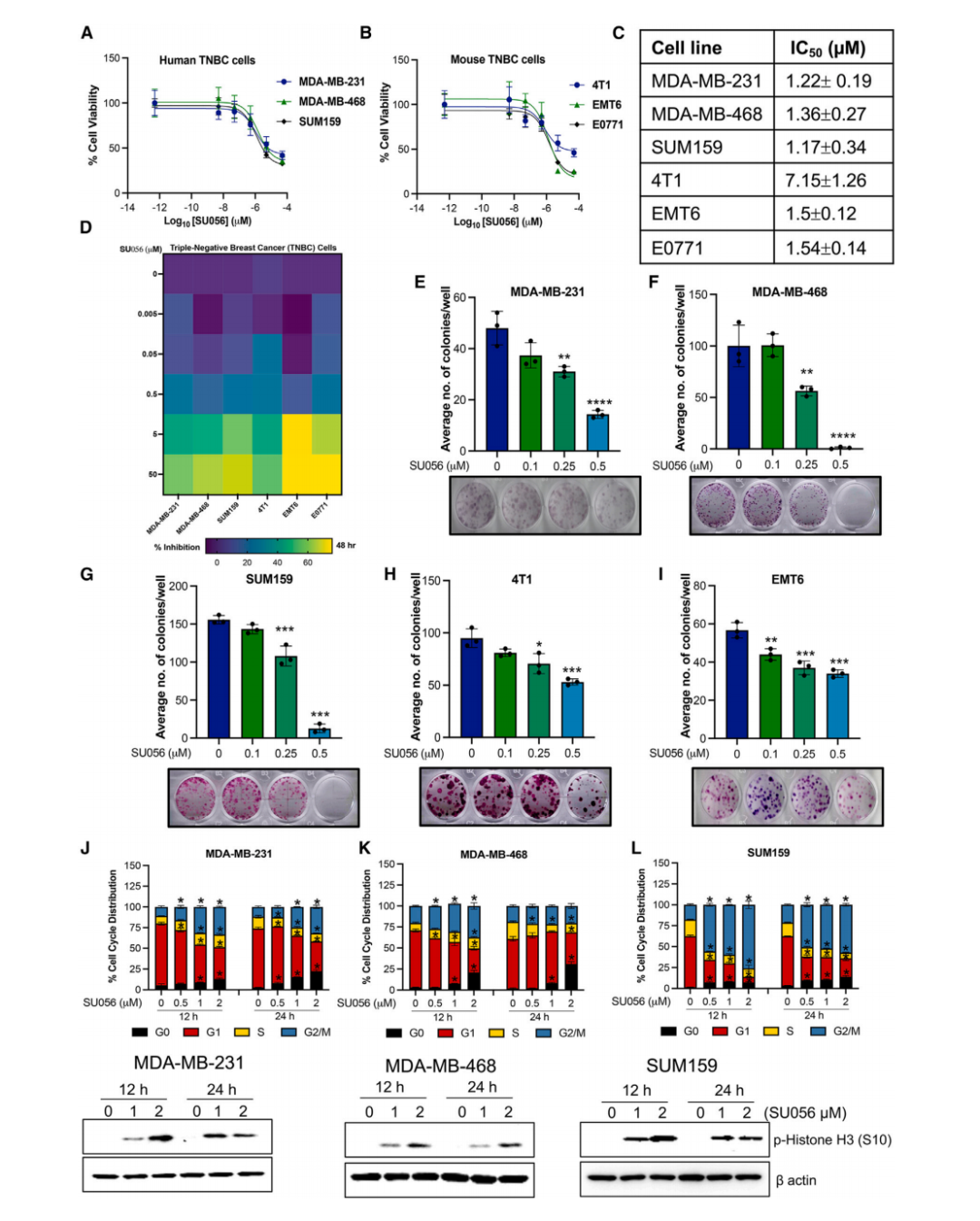
SU056减少人源和小鼠源TNBC异种移植瘤的生长
在人源和小鼠TNBC异种移植模型中,研究团队发现SU056能显著降低肿瘤生长和重量,且动物体重无明显变化,最大耐受剂量研究表明SU056在小鼠和大鼠中安全性高。此外,SU056还减少了4T1模型中的肺转移情况,这说明SU056在体内也有良好的抗肿瘤效果。
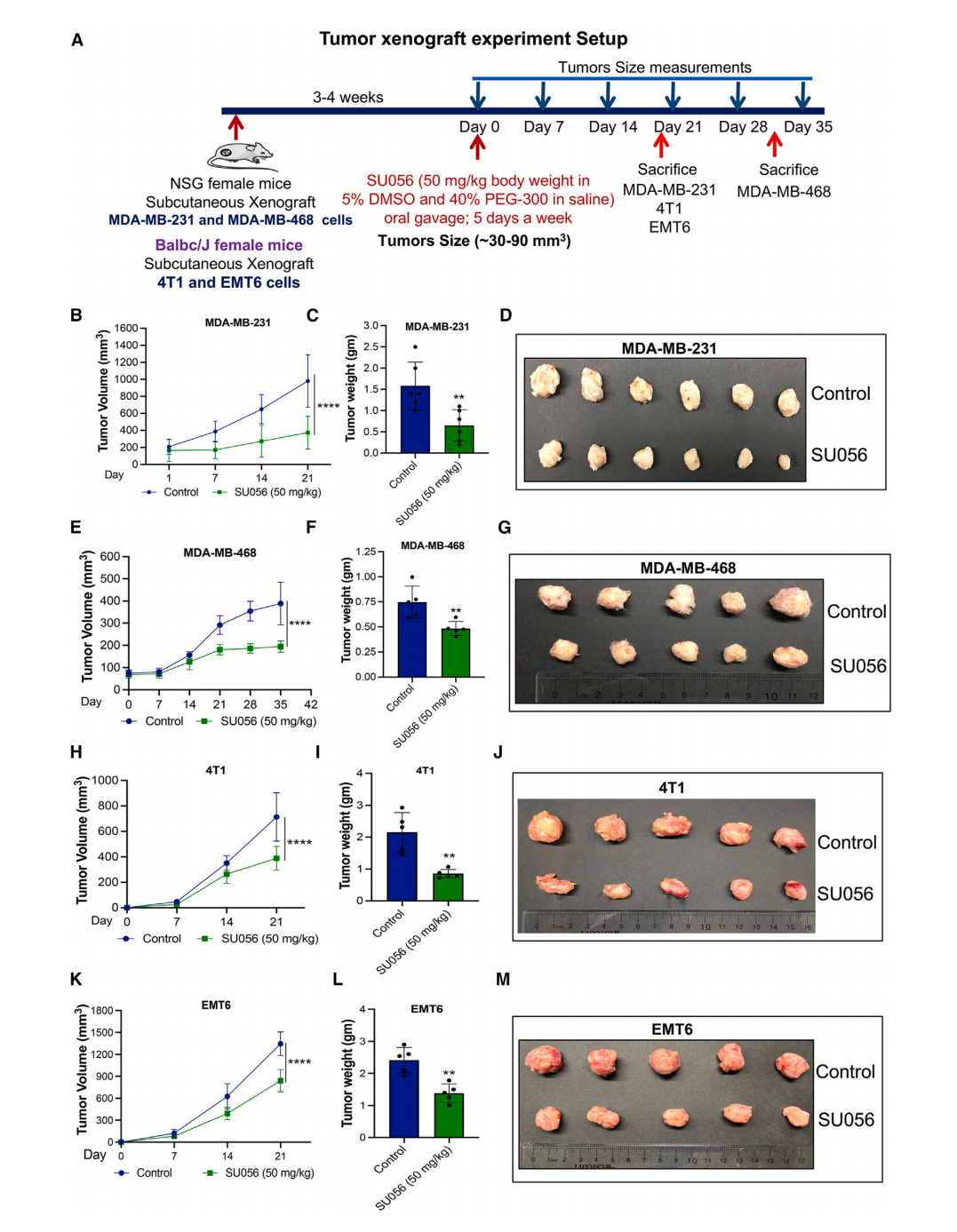
SU056减少患者来源的TNBC异种移植瘤的生长
在多种源自患者的TNBC异种移植模型中,研究团队发现SU056治疗显著降低了肿瘤生长,肿瘤体积和重量均减少。在治疗的过程中,动物的体重保持稳定。这些研究结果表明SU056在不同的TNBC模型中具有广泛的疗效,是一种极具潜力的治疗候选药物。

鉴定SU056的蛋白质翻译过程为靶点
通过蛋白质组学分析和细胞热位移分析,研究团队确定了蛋白翻译过程是SU056的作用靶点。蛋白质组学分析结果表明,经SU056处理的TNBC细胞,与蛋白翻译相关的过程(如肽链延伸、真核翻译终止、核糖体结构成分、翻译调节因子等)发生改变,其主要影响核糖体复合物成分,包括翻译起始因子和RPL、RPS亚基蛋白。
细胞热位移分析表明SU056处理增加了YB-1的热稳定性,且比较热稳定性发现SU056处理增加了翻译相关蛋白的整体稳定性。在YB-1敲低的条件下,SU056对翻译机器分子的热稳定性影响消失,这提示YB-1是SU056作用的关键分子。
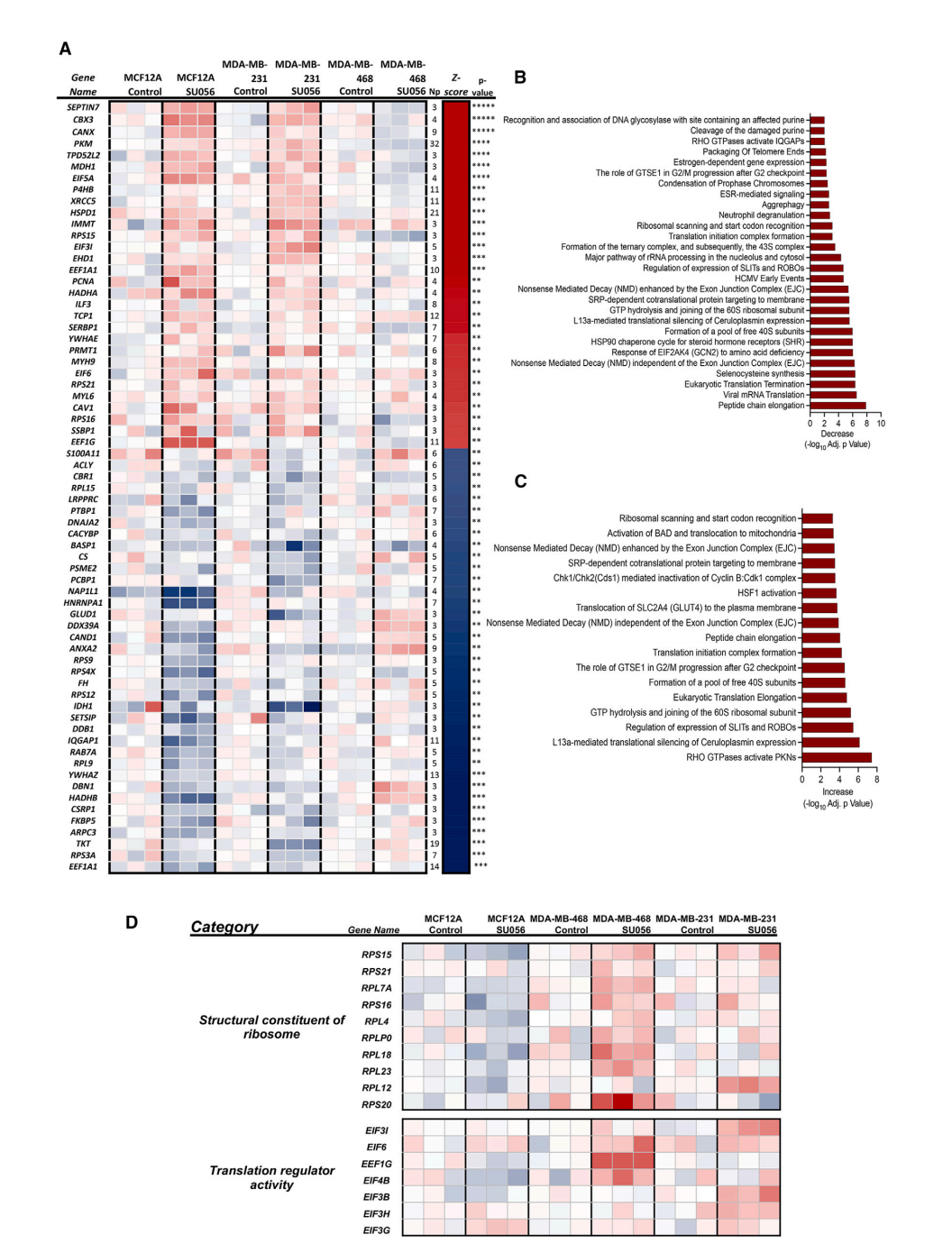
SU056靶向TNBC细胞中的翻译相关分子
SU056可抑制TNBC细胞中mTOR的磷酸化,降低其下游效应因子p70S6激酶和S6核糖体蛋白的磷酸化,减少YB-1及多种翻译起始因子的表达,降低核糖体蛋白(RPS和RPL)的表达,且这一过程不会引发综合应激反应的激活。
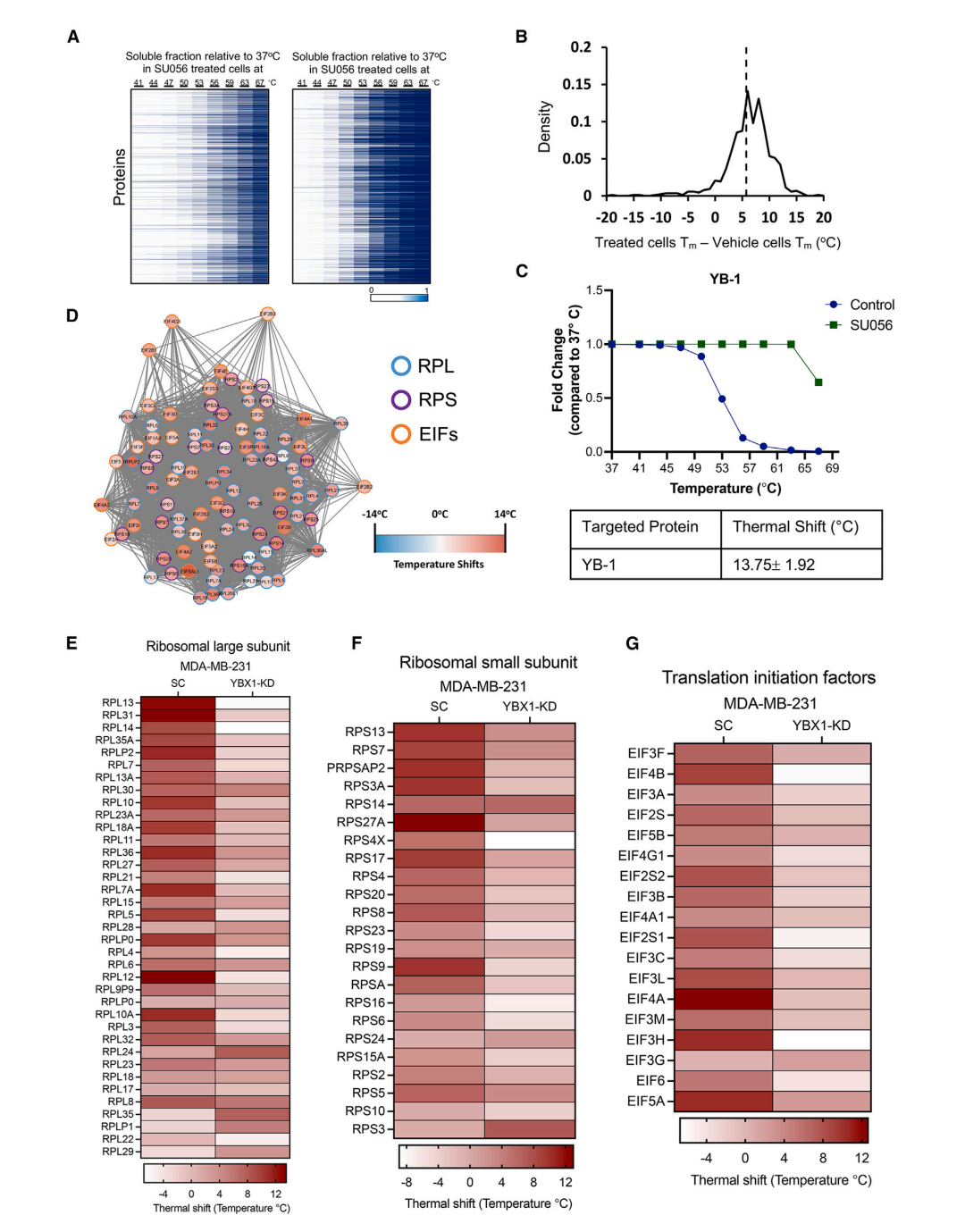
SU056与YB-1相互作用
免疫沉淀和下拉实验表明SU056与YB-1存在物理相互作用,抑制YB-1与RPL11的相互作用,YB-1的敲低会减弱SU056对RPL11表达的影响,且SU056会导致YB-1和RPL11降解,降低细胞的翻译效率。

该研究确定了SU056可作为三阴性乳腺癌(TNBC)的潜在治疗策略,它通过靶向Y-box结合蛋白-1(YB-1)抑制蛋白翻译机制,在多种TNBC模型中均显示出显著的抗肿瘤效果。利用蛋白质组学和细胞热位移分析,研究团队确认了SU056通过影响YB-1与RPL11的相互作用,干扰蛋白翻译过程,从而降低细胞翻译效率。此发现不仅为TNBC的治疗提供了新的思路和潜在治疗靶点,也进一步加深了对TNBC发病机制和治疗策略的认识。

云舟生物为其提供了hYBX1基因敲低慢病毒载体,相关shRNA序列如上。
这种载体可被用于沉默YB-1基因,以研究YB-1在三阴性乳腺癌(TNBC)中的功能以及SU056与YB-1相互作用的机制。通过沉默YB-1基因,可以观察到细胞中相关蛋白的表达变化、细胞生物学行为的改变等,从而推断YB-1在TNBC进展中的作用以及SU056作用的靶点和途径。
原文链接:
云舟生物科技(广州)股份有限公司创建于2014年,是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“VectorBuilder”平台(即“载体家”),开启了定制化基因载体的商品化时代,已累计向全球90多个国家和地区超4500家科研院校和制药公司提供服务,成果被上千篇Science、Nature、Cell等全球顶尖科研期刊广泛引用。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论