
传统上,将先进的科研成果转化为新型药物的制造,是一项充满挑战且漫长的工作。近年来,随着针对细胞外囊泡(Extracellular Vesicles,EVs)的研究不断深入,其被生物医药界寄予了厚望。目前,学术界建立的制备方法通过简单的规模扩大可以解决临床样品的需求,但是,这些方法通常缺乏可放大性,且无法满足《药品生产质量管理规范》(Good Manufacturing Practice of Medical Products,GMP)及相关监管的要求。因此,如何稳健地、大规模制备EVs,是EVs产业化发展道路上亟需跨越的一大障碍。本文将从促进EVs分泌、分离纯化、工程化策略等方面详细为大家阐述如何实现EVs的规模化生产。
目前,生物制品生产工艺流程通常包括原液和制剂生产,其中原液生产又分上游和下游过程,该流程同样适用于EVs的生产(图1)。基于EVs的特点,可以进一步细分为:细胞培养(通常从细胞库开始)、细胞预处理(如果有)、分泌、收获、纯化、制剂、灌装和成品、储存和运输。此外,EVs可以通过生产细胞系修饰(前载)或采用后装载的方式进行工程化改造,从而改善其特定靶向或治疗特性,并可以封装治疗药物,以保护它们免受降解,增强药效,同时最大限度地减少药物毒性。
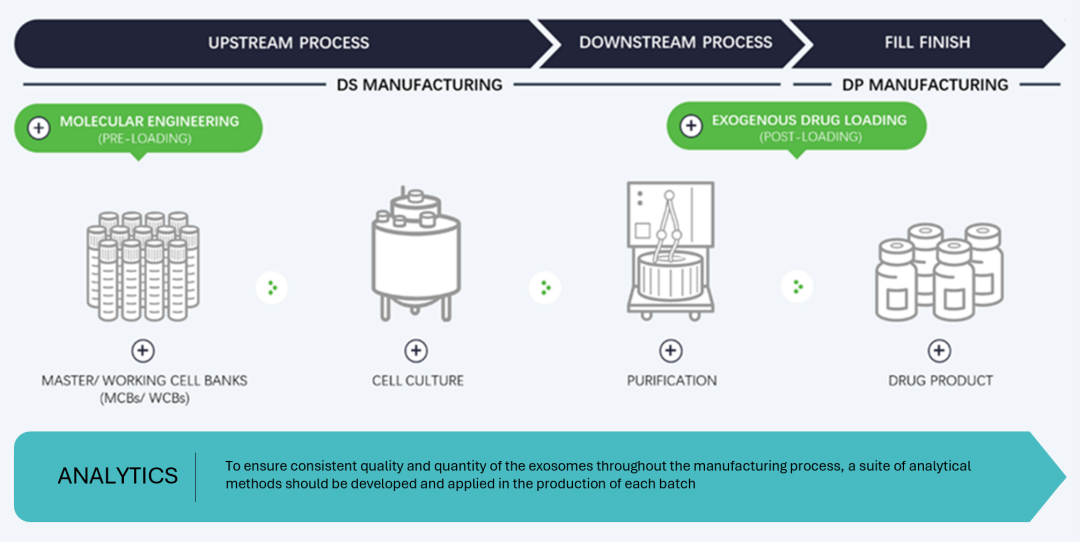
图1. 简化的EVs主要生产工艺流程图
EVs源自原代细胞或是细胞系,同种异体细胞或是自体细胞,天然细胞或是修饰细胞。EVs来源可能影响开发、生产和控制策略的多个步骤以及最终产品的复杂程度。根据研究性先进治疗法(Advanced Therapy Medicinal Products,ATMPs)指南(EMA/CAT/852602/2018),可以确定三种不同的生产策略:
直接使用的原代细胞
经过几次传代的原代细胞(细胞库)
基于明确界定的细胞库系统的细胞,该系统由主细胞库(Master Cell Bank,MCB)和工作细胞库(Working Cell Bank,WCB)组成
对于来自原代细胞的细胞库,可以考虑采用类似的细胞库管理办法。永生化细胞系则是更具吸引力的候选细胞,它们的使用能够通过减少复制性衰老来提高批次的一致性,但应优先考虑非致瘤性的永生化方法,以降低相关安全性风险。
对于细胞培养方式,细胞可以在贴壁模式下培养,即细胞附着在支撑物表面上,也可以在悬浮模式下培养,即细胞通过搅拌悬浮在培养基中。
贴壁培养:
贴壁培养的放大需要更大的表面积,可以在大型细胞工厂或固定床生物反应器上实现,也可以在搅拌式反应器中将细胞贴附在微载体上进行生产。传统上,贴壁培养需要添加胎牛血清,但血清本身也含有EVs,因此在使用前应采取适当措施予以去除,以免对生产的目标EVs造成污染。同时,血清的使用可能增加外源性病毒安全的风险。目前,市场上已有商业化的血清替代品或无血清贴壁培养基。与悬浮培养相比,贴壁培养往往规模放大难度高、更耗时、更昂贵且效率更低。
悬浮培养:
细胞工程技术的进步使得能够使用如HEK293等细胞系进行悬浮培养,这些细胞能在无血清培养基中生长,并具有快速增殖、易于培养和高效转染的特点,甚至表现出更高的产量。且通过此类细胞系生产的多种生物制品已获得美国FDA和欧洲EMA等批准。
目前EVs可以通过扩大生产规模来满足临床和商业用途,但在一致性、效率和成本效益方面存在挑战。因此,可以通过工程化改造细胞和优化培养体系促进EVs分泌(表1)。例如细胞调节(如过表达SDCBP、CD63、CD81等EVs蛋白)或刺激(如机械应力、乙醇等化学试剂、饥饿、低pH值、缺氧)可进一步增加EVs的产生(表1)。
表1. 促进EVs分泌的方法

上下滑动查看完整内容
此外,诸如连续灌流培养(Perfusion)(图2)等先进细胞培养模式已在单克隆抗体、重组蛋白等生物制药领域广泛应用,并取得了惊艳的效果,未来同样可以运用到EVs的规模化生产中,以实现在有限的培养容积内,大幅提高生产效率。
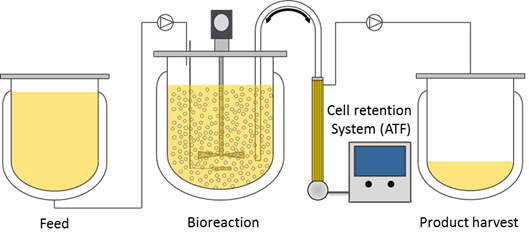
图2. 细胞灌流培养
EVs作为细胞分泌的囊泡颗粒,其所处的细胞培养环境复杂,且在尺寸、形态和生化特性等方面存在显著差异,因此,在分离纯化上存在诸多挑战。目前,常见的EVs分离方法主要包括超速离心、超滤、分子排阻层析、沉降分离、免疫学分离、亲和层析和微流控分离等(图3)。
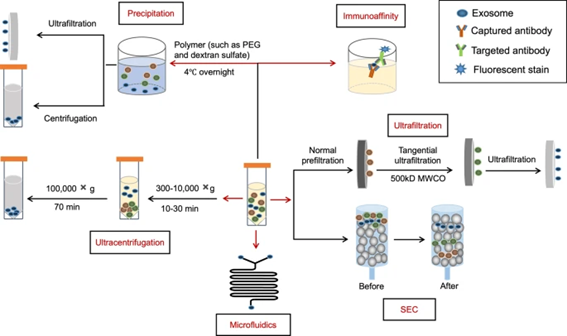
图3. 常见EVs分离纯化方法
我们总结了不同EVs分离方法的优劣势对比 (表2) 。在开发下游工艺时,需要基于EVs本身的特点,以及分离纯化的目的和规模要求,从EVs完整性、纯度、回收率、可放大性、效率、工作流程的简洁性和自动化程度等多个维度进行综合评估,选择适用的分离方法或组合,同时,还应考虑与上游工艺及制剂工艺的衔接。
表2. 常见EVs分离方法的优劣势对比

上下滑动查看完整内容
工程化EVs主要是指天然EVs经过生物工程技术处理后,具有增强的载药效率、靶向性以及抵抗机体清除率等特点的一类被改造修饰的EVs(图4)。通常这类EVs的大小和形状不会发生明显改变,但是根据不同的研究和应用目的,其负载物或内容物会有明显不同。
通过基因修饰或工程改细胞过表达EVs中的天然分子;
通过表达载体设计将“货物”(蛋白质或肽)与EVs富集蛋白融合,以将“货物”导入EVs;
在EVs表面表达膜蛋白,如受体,以特定地靶向某些细胞类型等;
对细胞进行非基因修饰,如利用细胞的天然能力摄取外源物质和药物来装载EVs;
在EVs生产后通过装载特定蛋白质、RNA、mi/pre-miRNA或药物进行修饰。
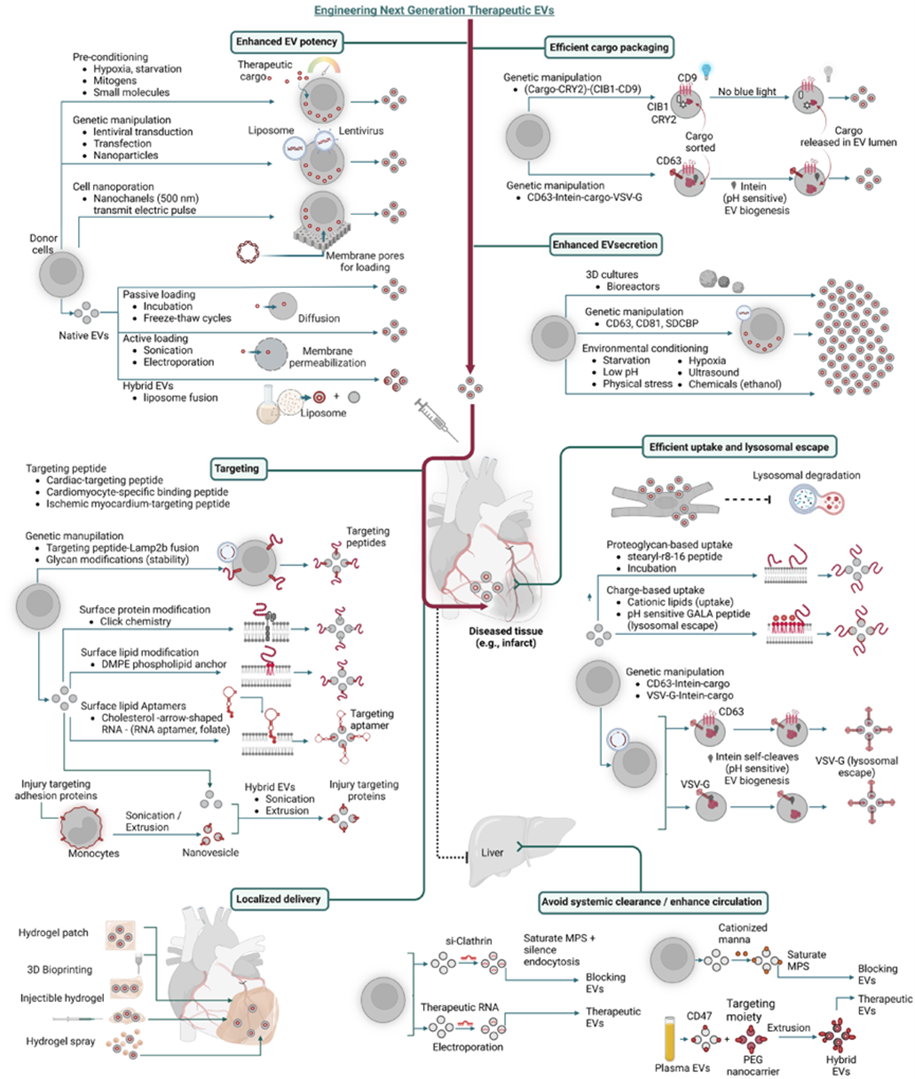
图4. EVs工程化策略
除了前面工程化策略中提到的通过细胞修饰或改造来获得工程化EVs,直接将外源性“货物”装载到EVs中也是可行的替代方案。包括被动装载(如孵育和冻融循环,依赖于货物自然扩散到EVs中)或主动装载(如超声处理或电穿孔,暂时使EVs膜通透)。虽然孵育依赖于药物分子的疏水性和其与囊泡膜脂质层的相互作用,但快速冷冻和解冻可能导致EVs聚集,从而限制了该方法的潜在优势。主动货物装载涉及化学(如皂苷表面活性剂)和机械技术(超声处理、电穿孔),通常因其较高的货物装载效率而受到青睐。然而,潜在的EVs膜变形可能影响药物释放动力学,EVs聚集(可通过含有海藻糖的缓冲液减少)要求进行全面稳定性和效力评估。当然,基于细胞稳定转染技术,以主动的前加载方式生产含有转基因产物的EVs,正越来越受关注。但应当注意的是,须识别由于使用病毒载体和/或转基因的存在而带来的特定风险,并应针对细胞库和产品制定相关的控制策略。

图5. EVs的“货物”装载技术
本文小编还为大家对比了不同装载技术的优劣势(表3),并通过结合工程化策略、“货物”类型、递送目的和生产规模等,可对“货物“装载技术进行理性选择。
表3. “货物”装载技术的优劣势对比

根据给药方式,可在EVs纯化或制剂阶段添加一种或多种原辅料,从而改善生物分布,如冷冻保护剂、缓冲液或其他合成物质等。此外,产品分类取决于赋形剂/生物材料在治疗作用中的角色,给药方式可能影响制剂(可注射、整合到生物材料中)和分离方法的选择。因此,应尽早确定给药方式,并根据临床前数据进行评估。局部给药在将EVs递送到感兴趣的部位方面具有优势,同时能限制全身循环。
如果EVs的作用部位未知,则应考虑除局部给药以外的其他给药策略。在临床前模型中,全身给药已得到广泛应用,如EVs靶向免疫系统或被工程改造以获得归巢特性,从而使其能够靶向特定组织,那么全身给药会是一个关键选择。
储存条件(温度、容器选择及冷冻保护剂使用)对EVs的数量与质量有着显著影响。针对不同应用需求与保存时长,可选择EVs短期储存在4°C或长期储存在-80°C,而冷冻干燥则可能是更好的存储方式。然而,每种方法均可能不同程度地削弱EVs功能,如4°C储存虽便捷,但易导致EVs聚集与降解;-80°C则成本高且依赖专业设备。选用硅化容器可有效降低EVs因表面吸附而造成的损失。此外,尽管生理盐水可用于EVs储存,但采用疫苗中常见的冷冻保护剂(如海藻糖)能更有效地防止EVs聚集与冷冻损伤,从而提升储存效果。
药品是治病救人的特殊商品,也是目前世界上监管最为严格的产品之一。EVs产品的创新性不仅仅体现在独特的作用机理和潜在的临床疗效,更可能为生物医药领域带来了一阵新风,其影响之深远可能超过人们的预期,但作为新型疗法,目前对其缺乏足够的认知。为保证EVs产品在预期用途中的安全性和有效性,应当严格遵守GMP的相关要求,从而最大限度地避免生产过程中的污染和交叉污染,减少各种混淆和差错的发生,以持续稳定地提高EVs产品的质量。
EVs在ATMPs领域蕴藏着巨大的潜力,与传统的基因疗法或细胞疗法相比,EVs药物具有免疫原性更低、粒径尺度更小、穿越生物屏障(包括血脑屏障)的能力更强等天然优势。此外,EVs还可以量身定制,从而携带药物、核酸或蛋白质等治疗载荷,精确到达靶细胞。未来的ATMPs可能使EVs发展成为多功能的药物输送载体,用于治疗癌症、神经系统疾病和炎症性疾病等多种疾病。与传统疗法相比,基于EVs的疗法能够提供更安全、更有效、副作用更小的治疗方案,有望显著改善临床治疗效果。
还有更多外泌体知识,请查阅本公众号往期推送:
????先进疗法的新星—细胞外囊泡
主要参考文献
[1]Welsh, Joshua A et al. “Minimal information for studies of extracellular vesicles (MISEV2023): From basic to advanced approaches.” Journal of extracellular vesicles vol. 13,2 (2024): e12404.
[2]Silva, Amanda K A et al. “Development of extracellular vesicle-based medicinal products: A position paper of the group "Extracellular Vesicle translation to clinical perspectives - EVOLVE France". Advanced drug delivery reviews vol. 179 (2021): 114001.
[3]Rai, Alin et al. “The Discovery of Extracellular Vesicles and Their Emergence as a Next-Generation Therapy.” Circulation research vol. 135,1 (2024): 198-221.
[4]Stawarska, A.; Bamburowicz-Klimkowska, M.; Runden-Pran, E.; Dusinska, M.; Cimpan, M.R.; Rios-Mondragon, I.; Grudzinski, I.P. Extracellular Vesicles as Next-Generation Diagnostics and Advanced Therapy Medicinal Products. Int. J. Mol. Sci. 2024, 25, 6533.
[5]Cheng,Ke Kalluri,Raghu.(2023).Guidelines for clinical translation and commercialization of extracellular vesicles and exosomes based therapeutics. Extracellular Vesicle.2.100029.
[6]Ahn, So-Hee et al. “Manufacturing Therapeutic Exosomes: from Bench to Industry.” Molecules and cells vol. 45,5 (2022): 284-290.
[7]Debbi L, Guo S, Safina D, Levenberg S. Boosting extracellular vesicle secretion. Biotechnol Adv. 2022 Oct;59:107983.
[8]Kim, H.I., Park, J., Zhu, Y. et al. Recent advances in extracellular vesicles for therapeutic cargo delivery. Exp Mol Med 56, 836–849 (2024).
[9]Wang, X., Xia, J., Yang, L. et al. Recent progress in exosome research: isolation, characterization and clinical applications. Cancer Gene Ther 30, 1051–1065 (2023).

????如您有任何业务需求,后台回复【业务咨询】
我们会尽快与您联系!
✔后台回复【PCV】
下载《健新原力mRNA个性化肿瘤疫苗解决方案》
✔后台回复【RNA】
下载《健新原力mRNA CDMO 技术服务手册》
✔后台回复【LNP】
下载Poster《The Application of Lipid Nanoparticle (LNP) -mRNA Delivery System in CAR-T Therapy》
更多资源详见【健新原力】公众号
菜单栏-关于我们-资源下载
欢迎点击查看
健新原力是专注于先进治疗药物(ATMP)的CDMO企业,致力于提供高质量端到端的质粒、RNA、LNP、外泌体、病毒载体、细胞治疗等解决方案。我们的先进车间符合FDA、EMA、NMPA的cGMP标准,并采取严格的政策和措施以保护客户知识产权。管理团队拥有丰富的行业经验,在美国、欧洲和中国已成功领导多个创新药从开发到商业化全流程。健新原力在工艺开发和生产方面拥有专业知识和丰富经验,致力于加速全球创新药的开发和商业化,是您值得信赖的合作伙伴。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论