
近日,南方科技大学王杰团队在Nature communication上发表了一篇名为《Genetically encoded Nδ-vinyl histidine for the evolution of enzyme catalytic center》文章,报道了通过遗传密码子扩展技术,将非天然化学修饰的氨基酸引入到蛋白质中,以改善其催化功能。
鉴于常位于酶活口袋中的组氨酸具有较高的催化活性,通过化学修饰酶催化中心的组氨酸,可以增强其化学多样性,从而赋予酶产生新的生物催化特性。在本文中,作者以δVin-H为研究对象,在翻译时,用δVin-H取代原始氨基酸,首先通过优化的吡咯赖氨酰tRNA合成酶,使翻译速率达到与野生型蛋白一致,然后,以酯酶(OE1.3变体)和卡宾转移酶(Mb*)为研究蛋白,验证了作为组氨酸衍生物的δVin-H,在提高酶生物催化活性上,具有很大潜力。
作者的整体实验设计如下,首先,鉴定出一种高效的吡咯赖氨酸氨酰-tRNA 合成酶(PylRS),使其有令人满意的δVin-H延伸效率。随后,作者将δVin-H分别掺入到OE1.3酯酶和Mb的反应中心,分别得到OE1.3和Mb的δVin-H突变体,经过一系列的实验证实,突变体蛋白都具有更高的酶活性和动力学特性。
δVin-H的设计&合成
在很多含组氨酸的催化反应中,咪唑环上的氮原子(Nε)是典型的活性中心,因此,Nδ-取代的非天然组氨酸有更强的催化活性,Nδ-methyl His就是个很好的例子。因此作者在组氨酸的Nδ位置引入了乙烯基基团,相比起δMe-H,对咪唑环的影响更为显著。在组氨酸的Nδ位置上引入乙烯基团,导致Nε位置的氢原子形成更强的酸性氢键,同时使得咪唑环的电子密度降低,来增强咪唑环上氮原子的亲核性,这对于亲核进攻或金属配位来说至关重要。天然氨基酸侧链的pKa一般在3~12之间,但是绝大部分天然氨基酸侧链的pKa值在生理条件的pH范围(4.5~7)外,也就意味着,这段范围的空白可能会限制蛋白质在生理pH条件下的功能优化。组氨酸作为pKa在生理pH范围内的天然氨基酸,作者利用此特性,将乙烯取代基的组氨酸pKa从7.07调节至5.71,填补了这一空白。

图1.Nδ乙烯基组氨酸的设计
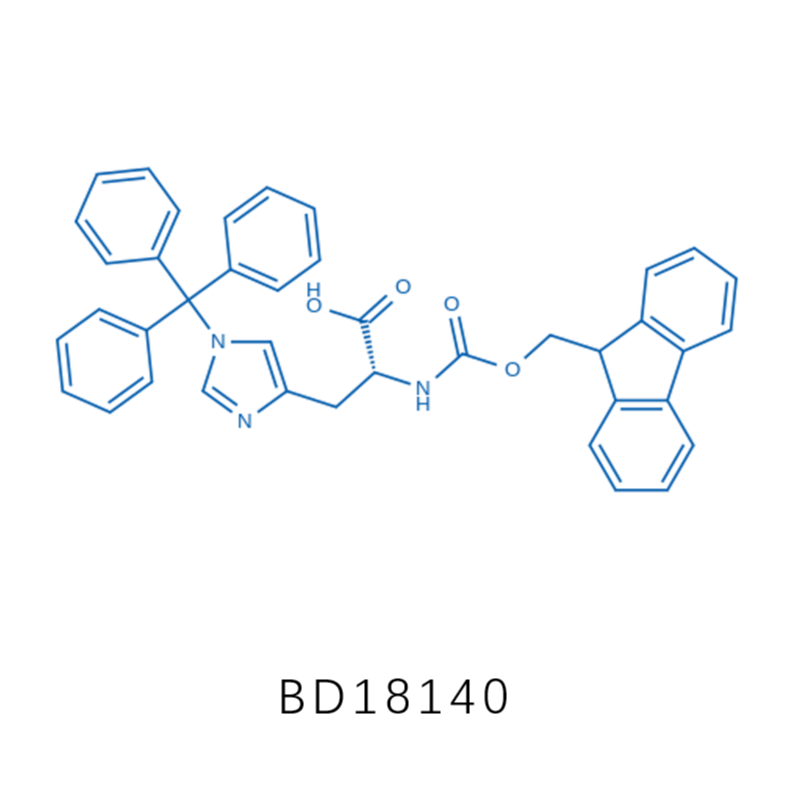
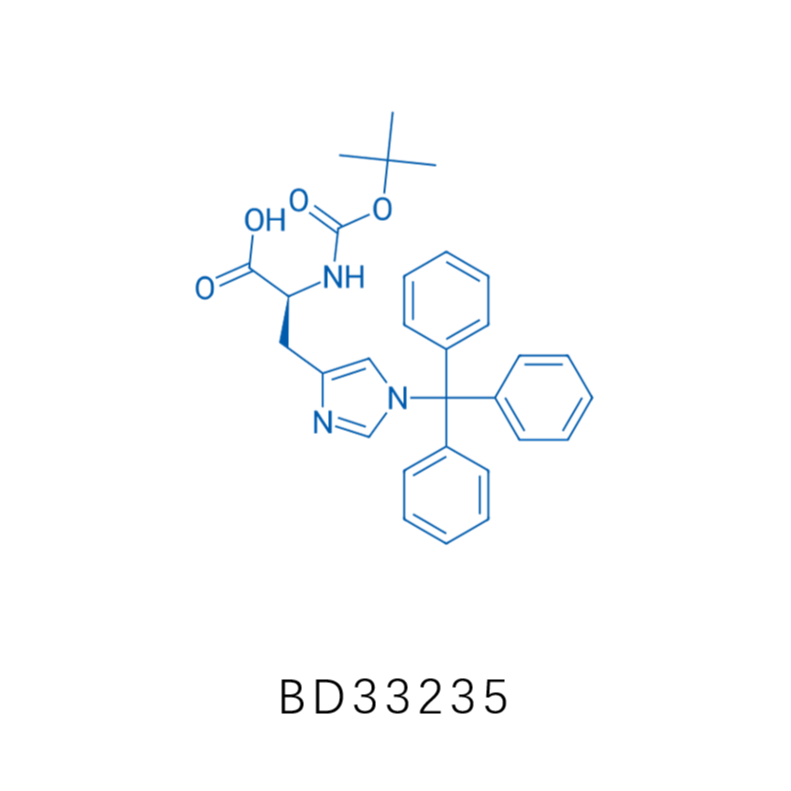
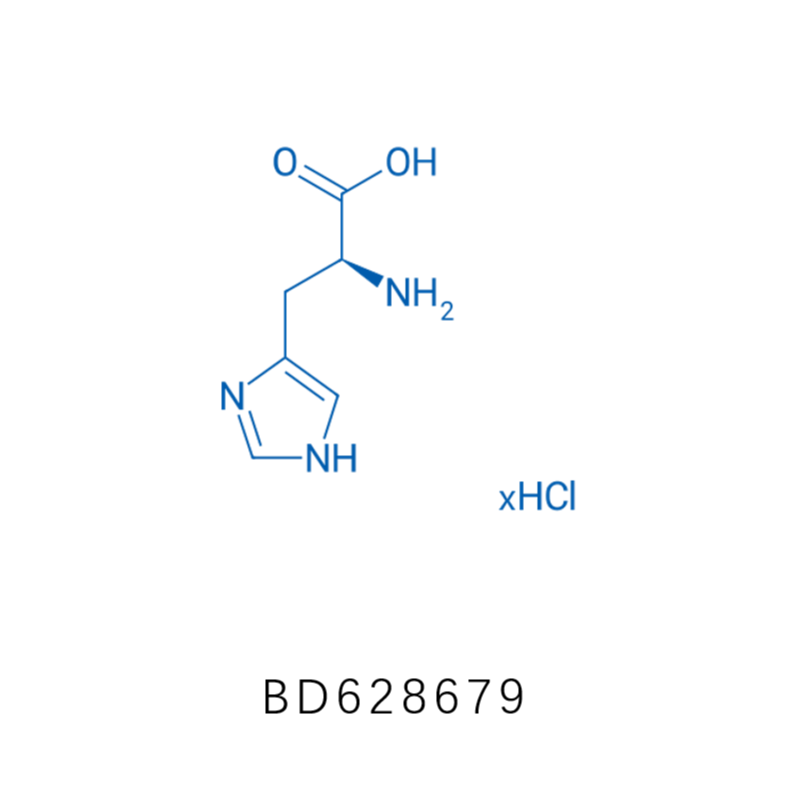
接下来,作者通过将化学合成得到的Nδ-乙烯基组氨酸通过遗传编码的方式掺入到蛋白中,以便于蛋白功能的优化。首先作者设计δVin-H的结构和相应的合成路径,如下图A,首先使用三苯甲基作为保护价团对组氨酸的Nε位置进行保保护(Boc-His(Trt)-OH,CAS: 32926-43-5,BD33235,该产品来自于毕得医药),再在Nδ位置引入了一个溴乙基,然后除去Nε位置的三苯甲基保护基,最后通过消除反应得到δVin-H,此反应还可以扩展到更大规模生产。最后通过2D NMR分析,证实乙烯基团加在Nδ位而非Nε位。
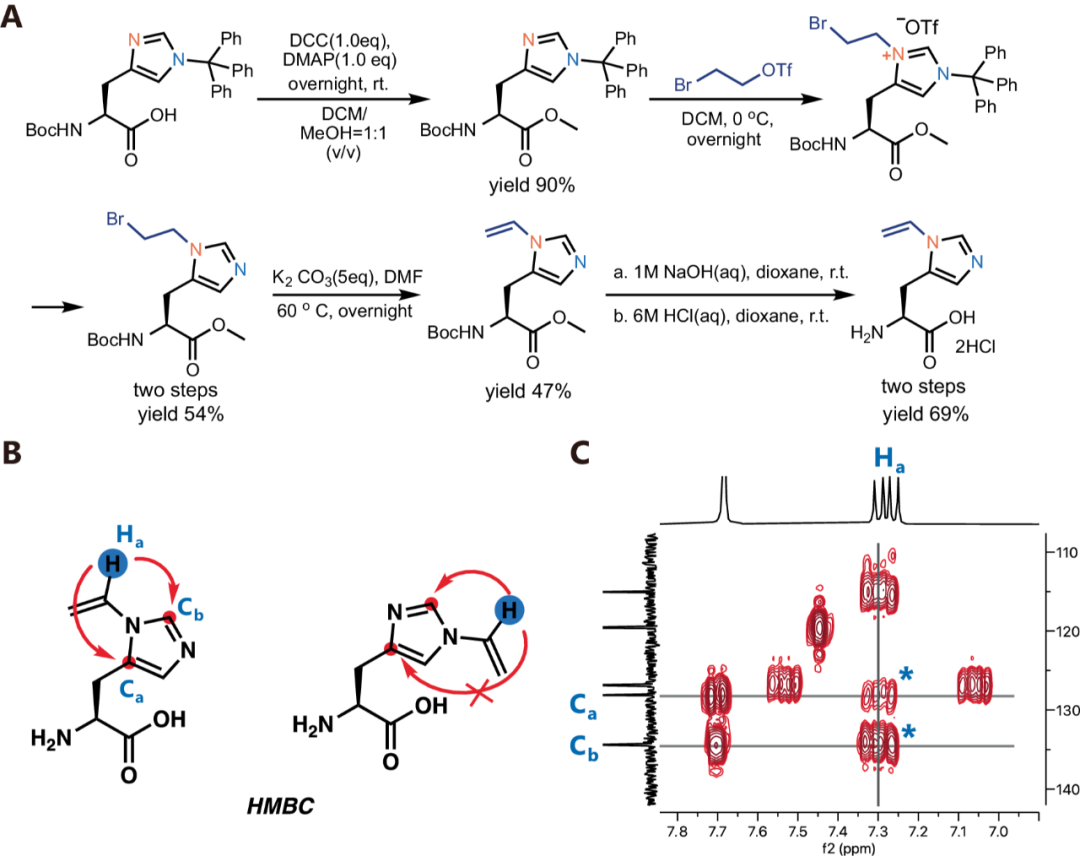
图2.δVin-H的合成与表征
δVin-H的遗传编码
基于前人设计的δMeH-RS(一种PylRS突变体),作者发现δMeH-RS也能识别δVin-H,但是效率很低。在此前提下,本文对δMeH-RS再做进一步设计改良,选择2个位点进行点突变,得到2种能识别δVin-H的突变体——hit #1和hit #2。随后,作者对N311D突变体在第270、271、274、313位氨基酸做了点突变,构建文库,并对文库进行筛选,发现了第三种能有效识别δVin-H的突变hit #3。对3种突变体进行延伸效率对比,发现hit #3为最优选择。它使δVin-H具有和WT相同的延伸速率。甚至在δVin-H只有0.1mM的低丰度时,GFP-δVin-H的表达量也能到达GFP-WT的50%。用hit #3进行大规模表达反应,得到的GFP-δVin-H与计算所得的分子质量一致,说明乙烯基咪唑在生理条件下的蛋白质表达期间能稳定存在。

图3.乙烯基组氨酸的遗传编码
δVin-H对酯酶(OE1.3)催化中心进行重构
在前人(Anthony Green 团队)研究工作的基础上,本文作者利用δVin-H让酯酶(OE1.3)扩大反应范围并进一步提高反应效率。OE1.3酯酶的催化机制中,组氨酸的Nε位置作为亲核基团进攻酯基,而决定反应速率的步骤涉及酰基-咪唑中间体的酰基释放。基于这机制,咪唑环质子化的比例决定了亲核能力和水解活性。作者将δMeH和δVin-H取代OE1.3酯酶关键位置处的组氨酸,并用WB和质谱对酶进行鉴定和纯化。在已知OE1.3可以很好的催化2-苯乙酸酯底物,本文利用苯氧甲醇酯(一种特殊的抗酯酶的内源性酯),进一步探究OE1.3-WT、OE1.3-δMeH, OE1.3-δVin-H在生理酸性环境中的活性。和期待的一致,pH=5.5时,OE1.3-δVin-H呈现出最好的水解活性。
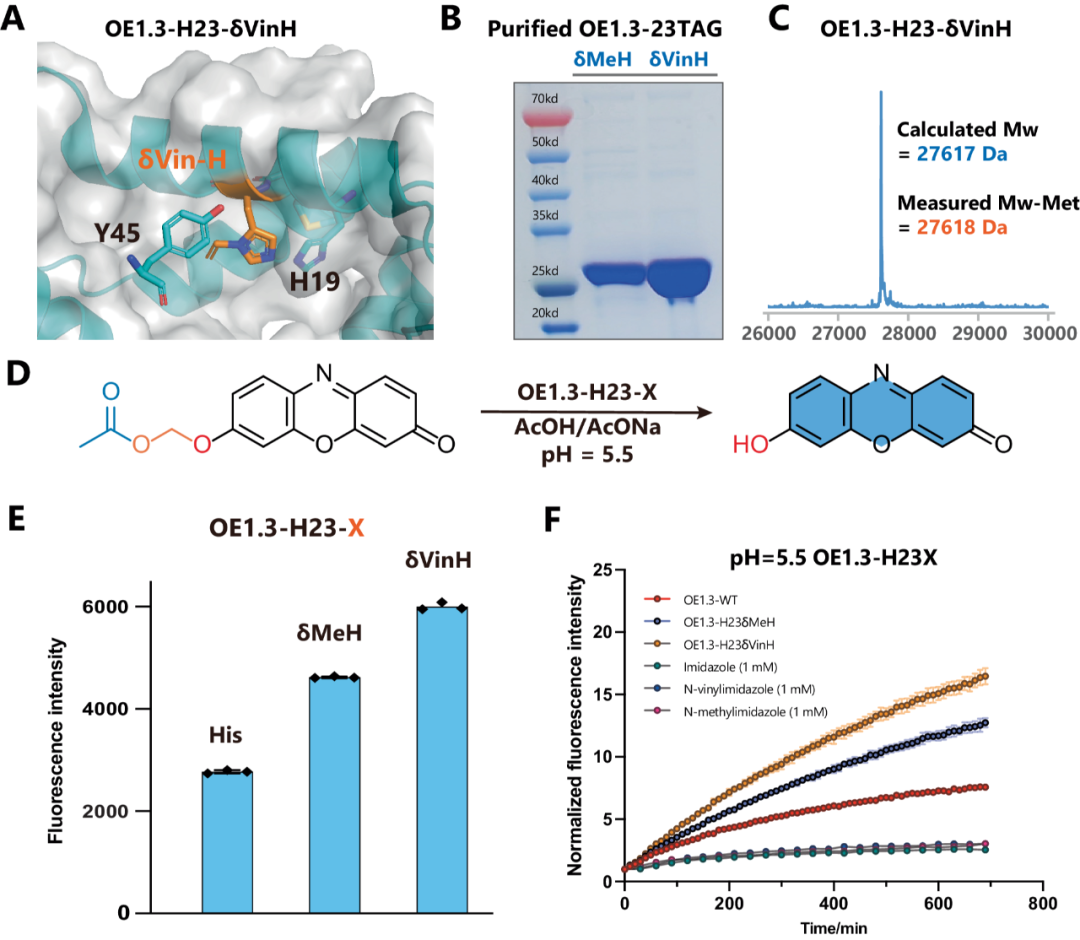
图4.乙烯基组氨酸重塑酯酶OE1.3的催化中心
组氨酸同样也是重要的金属结合位点,特别在含血红素蛋白的血红素轴位处。作者继续用δVin-H代替酶轴位处的组氨酸,通过对四种蛋白进行探究,得到令人振奋的结果,四种蛋白的δVinH 掺入效率都令人满意,证实了 δVin-H 在调节血红素依赖蛋白质的轴向配位方面的普遍适用性。

图5.将δVin-H基因编码到不同血红素依赖性蛋白中
δVin-H对卡宾转移酶进行优化
作者选用肌红蛋白突变体(Mb*)作为卡宾转移酶研究载体,对δVin-H取代后的影响进行探究,发现,Mb*-WT 和 Mb*-H93-δVin-H两种蛋白在静息状态下都有一样的可见光吸收光谱特征。调整为412 nm波长,并加入还原剂后,两种蛋白都在主要吸收峰出发生了红移。但是Mb*-H93-δVin-H的还原峰明显高于WT的还原峰。在进一步加入底物(EDA)后,Mb*-δVin-H 的还原峰显著下降,而Mb*-WT 中还原峰的变化不明显,表明脱氮以及重氮乙酸乙酯(EDA)与血红素结构的配位。这些结果都说明,Mb*-δVin-H 在还原过程和卡宾配位方面都比 Mb*-WT 更具反应性,并且将比 Mb*-WT 表现出更好的催化性能。
接下来,作者通过苯乙烯和 EDA 的环丙烷化反应,来对Mb*-WT 和 Mb*-H93-δVin-H的催化效率进行评估。在0.1% mol酶的有氧条件下,Mb*-δVin-H催化苯乙烯环丙烷化的产率将近80%,而Mb*-WT仅为30%。在富电子的苯乙烯底物中,Mb*-H93-δVin-H也同样有此效果。
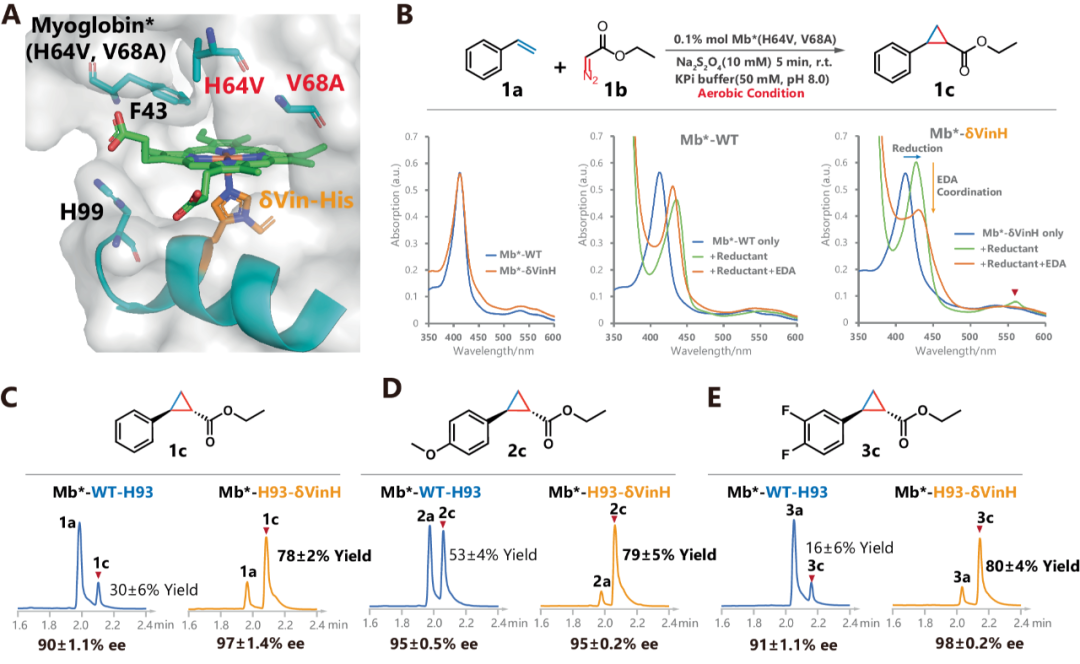
图6.通过在位点特异性引入δVin-H实现对肌红蛋白的优化
总体来说,本文作者在前人研究的基础上,通过遗传翻译的方式对酶催化中心位置的组氨酸进行修饰改造,得到显著提高酶活性能的人工酶。作者相信对酶催化中心的重塑将会成为酶工程中一种有力的工具。
相 关 产 品 推 荐
毕得医药分子砌块
产品库
总数12W+种
为您提供
更多选择
参考素材:https://doi.org/10.1038/s41467-024-50005-9
免责声明:
本文图片均来自于论文原文,版权归原作者和机构所有,如需转载,请标明出处。
如发现编辑错误,请给予指正。
往期精彩·回顾
# 毕得周一见





























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论