本文转载自微信公众号:细胞基因疗法
近日,Atsena Therapeutics公司宣布其开发的ATSN-101基因疗法I/II期临床试验的12个月安全性和有效性数据已在《柳叶刀》上发表。
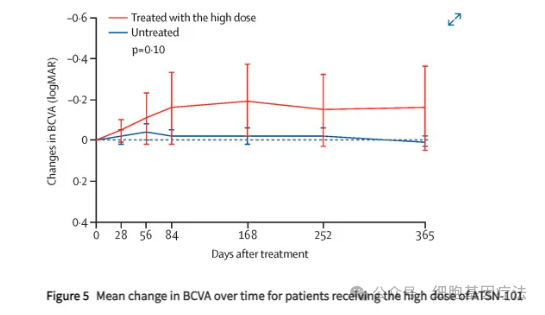
该试验评估了AAV基因疗法ATSN-101对由GUCY2D双等位基因突变引起的Leber先天性黑朦(LCA1)患者的疗效与安全性,研究人员表示,在某些情况下,接受最高剂量治疗的患者的视力提高了10000倍之多。ATSN-101最初由Atsena的创始人Shannon和Sanford Boye在美国佛罗里达大学开发,是首个用于治疗LCA1患者的基因疗法。

图片来源:Atsena Therapeutics
共有15名患者参与了该临床试验,其中包括3名儿童。LCA1是一种单基因眼病,会破坏视网膜的功能。它是由GUCY2D基因突变引起的,会导致早期严重的视力障碍。GUCY2D-LCA1是最常见的LCA形式之一,影响了大约20%患有此类遗传性视网膜疾病的患者。目前尚无针对LCA1的获批治疗方法。
ATSN-101是一款基于AAV5载体的基因疗法,用于治疗由GUCY2D双等位基因突变引起的LCA1,给药方式为视网膜下注射给药。ATSN-101最初由佛罗里达大学开发,将功能性人类GUCY2D引入光感受器。治疗后12个月,ATSN-101在高剂量下表现出持久的视力改善,并且耐受性良好。

E.N.D

往期文章推荐:
国家三部门联合发文:四个自贸区允许外资企业从事人体干细胞、基因诊断与治疗技术开发和技术应用!
国内首个《基于mRNA-LNP技术的(细胞)免疫治疗产品开发指南》团体标准正式发布
总投资7.7亿、建筑面积超20万平米,国内一细胞与基因治疗产业项目正式开工
全球首例化学诱导细胞来源的外囊泡产品NouvSoma001临床试验启动
国家卫生健康委发布“干细胞研究与器官修复”等共6个重点专项2024年度项目申报指南
中国首个:锐正基因基于非病毒载体的体内基因编辑药物ART001获美国FDA临床试验许可
全球首款,数据亮眼!瑞博生物首次公布靶向FXI的药物RBD4059临床I期数据




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论