康方生物双抗一线治疗NSCLC击败K药!
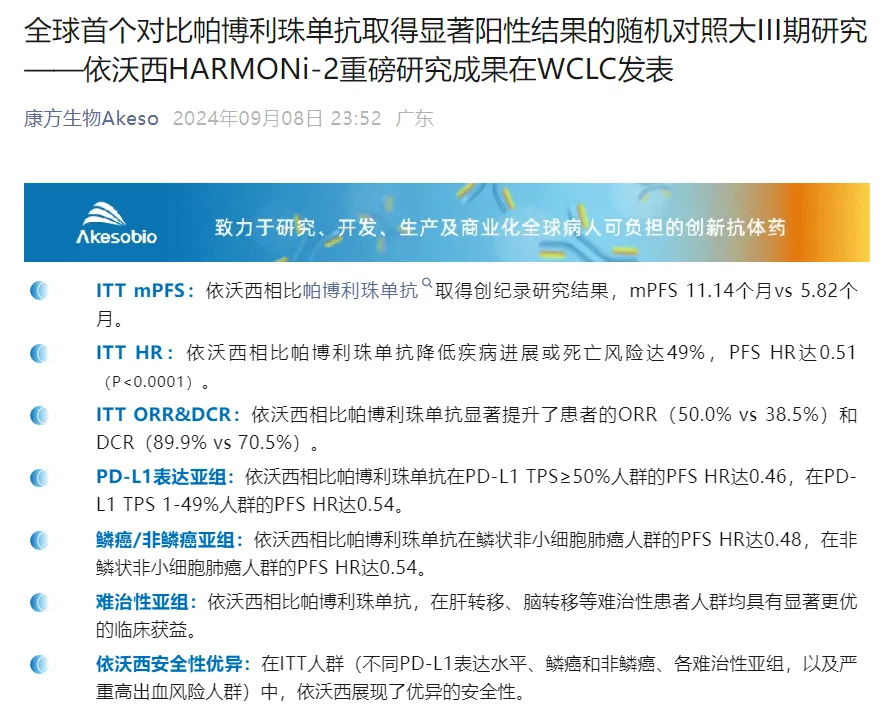
9月8日,康方生物在2024世界肺癌大会(WCLC)上发布了PD-1/VEGF双抗依沃西单抗单药对比帕博利珠单抗(K药)单药一线治疗PD-L1表达阳性(PD-L1 TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)的注册性III期临床研究(HARMONi-2/AK112-303)的重磅研究数据。依沃西HARMONi-2研究是全球首个对比帕博利珠单抗取得显著阳性结果的随机、双盲、对照III期临床研究。
该研究作为Late-Breaking Abstract(LBA)在本届大会以Oral形式重磅发布。HARMONi-2研究试验组与对照组入组人群基线均衡,其中PD-L1 TPS≥50%患者的占比为42.2%,与真实世界人群分布一致。结果显示,在意向治疗人群(ITT)中,依沃西单抗单药相较于K药单药显著延长了患者的无进展生存期(PFS),显著降低了患者的疾病进展或死亡风险(11.14 vs. 5.82个月,HR=0.51,P<0.0001)。此外,相比于K药,依沃西单抗也显著提高了患者的客观缓解率(50.0% vs. 38.5%)和疾病控制率(89.9% vs. 70.5%)。截至本次发表日,该研究的总生存期(OS)数据尚未成熟。亚组结果与ITT结果趋势保持一致,包括年龄、性别、ECOG评分、PD-L1表达、病理类型以及是否伴有肝转移、脑转移等亚组。具体数据如下:在PD-L1 TPS≥50%人群中,依沃西单抗组患者的疾病进展或死亡风险相比K药组降低了54%;在PD-L1 TPS为1-49%人群中,依沃西单抗组患者的疾病进展或死亡风险相比K药组降低了46%;
在鳞状NSCLC人群(45.5%)中,依沃西单抗组患者的疾病进展或死亡风险相比K药组降低了52%;在非鳞状NSCLC人群(54.5%)中,依沃西疾病进展或死亡风险相比K药组降低了46%。
在脑转移人群(16.7%)中,依沃西单抗组患者的疾病进展或死亡风险相比K药组降低了45%,无脑转移人群的数据为47%;
- 在肝转移人群(12.6%)中,依沃西单抗组患者的疾病进展或死亡风险相比K药组降低了53%,无肝转移人群的数据为47%。
安全性方面,依沃西单抗整体安全性优异,与既往相关研究保持一致。本研究接受依沃西单抗治疗的鳞癌患者有72.2%为中央型,10.0%患者的肿瘤存在空洞、坏死,6.7%患者存在肿瘤包绕重要血管,这些患者人群是传统抗VEGF治疗的禁忌人群,依沃西单抗治疗的出血风险与对照组相比未明显增加。在鳞状NSCLC人群中,依沃西单抗组与K药组的≥3级TRAE发生率相当(22.2% vs. 18.7%)。依沃西单抗组患者的整体生活质量亦与K药组相当。基于本次研究的积极结果,公司的合作伙伴SUMMIT亦宣布,现已计划开展HARMONi-7研究,用于评估依沃西单药对照帕博利珠单药在一线治疗PD-L1高表达(PD-L1TPS>50%)转移性NSCLC的全球多中心III期临床试验。 据悉,目前,依沃西单药一线治疗PD-L1表达阳性NSCLC的适应症的新适应症上市申请,已被国家药品监督管理局药品审评中心(CDE)纳入优先审评程序,有望于2025年获批上市。康方生物创始人、董事长夏瑜表示,帕博利珠单抗是近年来全球商业化最成功的创新药物之一,依沃西对比帕博利珠单抗在随机双盲III期研究中获得显著阳性结果,展现的卓越的疗效和可控的安全性,证实了依沃西作为肿瘤免疫治疗(IO)基石产品的巨大潜力。HARMONi-2的研究成果,也让康方生物和我们的海外合作方Summit Therapeutics对依沃西在全球范围内开展的III期临床研究获得成功更加充满信心和期待。”第三代 Bcr-Abl 抑制剂「泊那替尼」在中国获批,治疗白血病
9月9日,国家药品监督管理局(NMPA)官网显示,大冢制药的泊那替尼片(ponatinib)的上市申请已获得批准,用于:1)既往用药耐药或不耐受的慢性髓性白血病(CML);2)复发或难治性费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL);3)T315I阳性慢性髓性白血病(CML)或T315I阳性费城染色体阳性(Ph+)急性淋巴细胞白血病(ALL)。
泊那替尼是一款克服T315I突变的第三代Bcr-Abl抑制剂,对T315I突变型Bcr-Abl激酶具有高效特异性抑制作用,可有效解决现有Bcr-Abl抑制剂普遍存在、因激酶突变引起耐药性的缺陷,该药还对其他激酶有一定的抑制作用,包括VEGFR、PDGFR、FGFR、EPH受体和SRC家族的激酶,以及KIT、RET、TIE2和FLT3。泊那替尼最早于2012年12月获FDA批准上市,用于治疗对酪氨酸激酶抑制药耐药或不能耐受的慢性髓性白血病(CML)患者。

2014年,大冢制药与ARIAD Pharmaceuticals达成合作,大冢制药以7750万美元的预付款和后续的里程金获得了在10个亚洲国家共同开发和商业化泊那替尼的权益。据医药魔方数据库,2023年泊那替尼为大冢制药带来了5340万美元的收入,2023年泊那替尼的全球收入为5.82亿美元。
泊那替尼治疗CML和Ph+ALL患者的疗效已在II期PACE研究中得到验证。该研究评估了泊那替尼45mg每日1次治疗CML和Ph+ALL患者(对TKI耐药或不耐受和/或伴有T315I突变)的疗效和安全性。2018年发表在Blood杂志上的5年随访数据显示,经泊那替尼治疗的慢性期CML患者,主要细胞遗传学缓解(MCyR)率可达55%,其中82%患者维持至5年随访终点;5年无进展生存期(PFS)率和总生存(OS)率分别高达53%和73%。在32例Ph+ALL患者中,13例(41%)患者达MaHR,维持缓解时间(DoR)为3.2月;MCyR率、完全细胞遗传学缓解(CCyR)率分别为47%及38%;中位PFS为3.0月,3年OS率为12%。安全性方面,泊那替尼治疗相关的最常见不良事件(AEs)为高血压、皮疹、血小板减少、腹痛等。第二项适应症获批!圣和药业 EGFR 抑制剂一线治疗肺癌
2024年09月09日,国家药品监督管理局(NMPA)官方网站公示,南京圣和药业股份有限公司自主研发的化学1类创新药品种「甲磺酸瑞厄替尼片」(商品名:圣瑞沙,受理号:CXHS2300115)获得NMPA批准,用于具有表皮生长因子受体(EGFR)外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。本次获批是甲磺酸瑞厄替尼片继今年6月11日获批二线适应症后的第二项适应症。
甲磺酸瑞厄替尼片是圣和药业自主研发的第三代表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI),其不可逆地结合突变形式的EGFR(T790M、L858R和19外显子缺失),通过抑制EGFR突变体及其下游信号通路,发挥抑制肿瘤细胞增殖及促凋亡的作用[1]。本次新适应症获批是基于一项随机、对照、双盲、多中心的III期临床研究(SHC013-III-01),共纳入246例未经系统性抗NSCLC治疗的EGFR敏感突变阳性局部晚期或转移性NSCLC患者,按2:1随机接受瑞厄替尼200 mg每天一次治疗或吉非替尼250 mg每天一次治疗,直至出现疾病进展或不可耐受的毒性。主要终点为根据实体瘤疗效评价标准1.1版(RECIST 1.1)评估的无进展生存期(PFS),次要终点包括总生存期(OS)、客观缓解率(ORR)、缓解持续时间(DoR)、疾病控制率(DCR)和安全性等。与吉非替尼组相比,本品显示出具有统计学和临床意义的PFS获益,瑞厄替尼组和吉非替尼组的中位PFS(mPFS)分别为19.3个月和9.8个月(HR=0.46,95% CI:0.33,0.65,p<0.0001)。作为第三代EGFR-TKI,NSCLC患者长期服用本品的安全性和耐受性较好。药物不良反应,如皮疹、肝功能损害和血细胞减少等,在本品中的发生率均较低。其它风险较高的重要不良反应在本品中的发生率也较低,如间质性肺病(0%)、心肌收缩力改变(0.2%)和眼部疾病(2.1%)等。甲磺酸瑞厄替尼片在有效治疗肺癌的同时,保障了患者用药的安全性和长期获益。此外,本品用于术后辅助治疗II-IIIB期EGFR突变的NSCLC患者的研究(SHC013-III-02)也正在进行中,预计本适应症研究完成并获批上市后,有望降低早期NSCLC患者术后复发的风险,使更多的患者获益。








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论