健新原力基于成熟的mRNA-LNP技术平台和经验,开拓全新的mRNA个性化肿瘤疫苗平台(Personalized Cancer Vaccine, PCV),致力于为客户提供更快速、更合规、更经济、个性化的PCV CDMO服务。
随着全球多个自体CAR-T细胞疗法的获批,肿瘤的治疗方式逐步多样化,个性化医疗逐渐进入视野,成为新的治疗选择。目前上市的CAR-T适应症均为血液瘤,而对于实体瘤而言,手术治疗仍然是首选的根治性治疗方案。但是,术后的复发和转移仍是目前恶性肿瘤治疗中的痛点。
肿瘤疫苗利用肿瘤特异性抗原诱导机体APC细胞抗原递呈和T细胞免疫反应,从而对肿瘤细胞进行特异性杀伤。这种疗法不仅可以对术后残留的肿瘤病灶进行清除,也能有效作用于远端转移的肿瘤细胞,因此它的适应症范围更加广泛,拥有解决当前免疫疗法难以克服的痛点的潜力。
随着mRNA技术的发展,mRNA PCV逐渐登上特异性免疫治疗的舞台。PCV是通过测序和生信手段鉴定患者自身肿瘤中的新抗原序列,利用这些新抗原设计个性化肿瘤疫苗,从而特异性的杀伤体内肿瘤细胞,达到预防复发以及治疗的作用。另外,相比于其他免疫疗法点,PCV拥有的安全性高、特异性好、逆转“冷肿瘤”免疫微环境的特点:
安全性高
PCV在体内直接转录成蛋白,生物降解性良好,且不会整合到基因组,因此安全性高,副作用少。目前的临床试验披露结果均表明PCV未引起严重的不良反应;
特异性好
个性化肿瘤新抗原能引起机体针对自身肿瘤特异性抗原的免疫反应,且同时编码>20个肿瘤抗原,这使得它能够针对多种肿瘤突变,提高抗肿瘤的精准度;
逆转“冷肿瘤”
PCV可诱导肿瘤抗原特异性T细胞反应,且免疫效果强、持续时间久,改变肿瘤免疫微环境,增强抗肿瘤免疫反应。因此,PCV可单独或结合其他疗法用于预防肿瘤切除后的复发,也可用于晚期肿瘤的治疗。
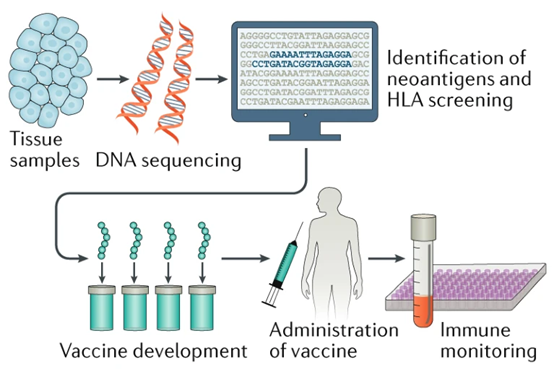
图1. 个性化肿瘤疫苗End-to-End流程图 [1]
目前,从全球发展来看,Moderna 和 BioNTech已成为mRNA PCV行业中的先行者,其各自的PCV产品mRNA-4157 (V940)和Autogene cevumeran (BNT122)均采用个性化mRNA序列并利用纳米脂质体颗粒递送。根据目前的临床数据,均展现出安全性和积极疗效,并能有效预防切除后肿瘤的复发。其中,Moderna与默沙东共同开发mRNA-4157/V940的mRNA个性化肿瘤疫苗,用于辅助治疗高风险黑色素瘤患者。根据最新披露信息,在名为KEYNOTE-942的2b期临床试验中,157名高危黑色素瘤患者,为期34.9个月中位随访时间中,V940联合K药(PD-1免疫抑制剂,帕博利珠单抗, KEYTRUDA)相比单独使用K药,可使复发或死亡风险降低49%,远端转移或死亡风险降低62%。V940联合K药的2.5年无复发生存率为74.8%(单独K药为55.6%)[2]。
除了Moderna 和 BioNTech,还有一家位于美国的ATMP公司Gristone bio,该公司的个性化疫苗管线GRANITÉ已进入临床PhaseⅡ&Ⅲ阶段,用于晚期转移性微卫星稳定的结直肠癌(MSS-CRC)的一线治疗。不同于Moderna的V940以及BioNTech的BNT122,GRANITÉ是利用腺病毒和自复制RNA (saRNA)两次递送个性化肿瘤新抗原的癌症疫苗,并通过简单的肌肉注射给药。从今年4月1日临床披露的Ⅱ期临床结果来看,GRANITÉ有着良好的安全和耐受性。这项随机对照、开放标签研究中的患者被1:1随机分配,接受疫苗联合疗法(5-FU + Bevacizumab + Atezolizumab + Ipilimumab + GRANITÉ)治疗的实验组以及仅接受5-FU + Bevacizumab治疗的对照组,其中Atezolizumab在之前的临床试验中被证明对该类型病人无益处。这次公布的数据包含67位患者的临床数据分析,结果显示,疫苗联合疗法相较于对照疗法,患者疾病进展或死亡风险下降了18%。如果是高危患者,则疾病进展或死亡风险降低48%。且在高危患者中>90%有肝脏转移,这些患者使用疫苗联合方案后,平均11.57个月肿瘤未进展,而对照组只有7.06个月[3]。这项随机研究表明,对于很难从免疫治疗中获益的“冷肿瘤”,个性化肿瘤新抗原疫苗有可能提高转移性“冷肿瘤”的免疫治疗反应,从而提高免疫疗法疗效,为晚期微卫星稳定的肿瘤患者带来新的希望。
随着头部企业moderna和BioNTech在临床的初步成功,中国mRNA企业也纷纷入局,但大部分仍处于早研以及IIT临床阶段,因此披露的消息不多。不过到目前为止,中国mRNA PCV的临床登记数量已占全球总数的一半。小编利用“mRNA cancer vaccine”关键词在Clinical Trials以及Chinese Clinical Trial Registry (ChiCTR)上检索,然后再通过“personalized”、“individualized”手动筛选出了28个mRNA个性化肿瘤疫苗登记临床项目(图2)。虽然还没有临床结果的披露,但就目前全球发展势头以及国内多家企业入局情况来看,PCV可能成为ATMP先进疗法领域的下一个蓝海市场。

虽然个性化、精准化治疗是未来的肿瘤治疗发展方向,但目前PCV作为一个新兴治疗方法,在生产工艺方面仍然面临着不小的挑战[4]:
生产周期长
为了避免患者可能在等待治疗期间出现疾病复发或进展,目前对个性化肿瘤疫苗的生产周期要求从测序到药物放行仅有6-7周的时间,而传统的RNA工艺无法解决生产周期长的问题;
成本较高
每个患者的药物都需要独立进行不同批次GMP生产,这导致生产成本高昂。同时目前的RNA的生产规模偏大,也会在工艺上增加生产成本;
交叉污染的风险
不同患者的疫苗分子序列均不相同,如何保证不同病人的药物在完成快速生产的同时避免交叉污染和防止混淆是一个很大的挑战;
安全和合规问题
个性化肿瘤疫苗生产和申报目前并没有出台明确的法规进行指导,而为了实现药物低成本、有效、快速、安全,达到更大的可及性,需要对现行的监管和申报的规则进行合理优化。
为了应对市场以及生产工艺的挑战,健新原力依托于丰富的mRNA-LNP CDMO平台经验,并不断开拓创新,增加定制化、个性化设备与GMP厂房,建立了全新的mRNA个性化肿瘤疫苗服务平台,为客户提供更快速、更合规、更经济、更加个性化的PCV CDMO服务。
更快速:大大缩短患者回输周期
- “工作站式”工艺流程,优化并缩短生产周期
- 6-7周实现产品放行
- 可多批次同步进行生产,且保证完全隔离不混批
更合规:确保每一位患者产品安全可追溯
- 独立专用的GMP厂房及设备
- COI /COC系统保障全药品周期信息追溯
- 全封闭一次性管路系统避免交叉污染
个性化:更经济的单个患者小规模批次生产
- 全线小规模自动化生产,成本可控
- 针对性IPC (in-process control) 及检测放行策略
健新原力mRNA个性化肿瘤疫苗CDMO服务平台将致力于为客户提供最优质的端到端的生产服务,我们的多平台多项目经验将为个性化肿瘤疫苗的生产和申报保驾护航,助力PCV药物快速上市。我们期待与更多的合作伙伴携手共进,共创ATMP医药行业的美好未来。

☞了解更多健新原力mRNA PCV相关业务
后台回复【PCV】下载业务介绍手册。
☞如您有PCV相关业务需求,后台回复【业务咨询】
我们会尽快与您联系!
▶上游工艺新策略——如何应对质粒载体在mRNA等新应用中的挑战
▶健新原力赋能RNAimmune公司创新型呼吸道合胞病毒mRNA疫苗的临床试验IND获得FDA批准
Reference:
1. Waldman, A.D., Fritz, J.M. & Lenardo, M.J. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nat Rev Immunol 20, 651–668 (2020).
2. https://news.modernatx.com/news/news-details/2024/Moderna--Merck-Announce-3-Year-Data-For-mRNA-4157-V940-in-Combination-With-KEYTRUDAR-pembrolizumab-Demonstrated-Sustained-Improvement-in-Recurrence-Free-Survival--Distant-Metastasis-Free-Survival-Versus-KEYTRUDA-in-Patients-With-High-Risk-Stage-IIIIV/default.aspx
3. https://ir.gritstonebio.com/news-releases/news-release-details/gritstone-bio-announces-positive-preliminary-progression-free
4. Lin, M.J., Svensson-Arvelund, J., Lubitz, G.S. et al. Cancer vaccines: the next immunotherapy frontier. Nat Cancer 3, 911–926 (2022). https://doi.org/10.1038/s43018-022-00418-6
✔后台回复【PCV】
下载《健新原力mRNA个性化肿瘤疫苗解决方案》
✔后台回复【RNA】
下载《健新原力mRNA CDMO 技术服务手册》
✔后台回复【LNP】
下载Poster《The Application of Lipid Nanoparticle (LNP) -mRNA Delivery System in CAR-T Therapy》
更多资源详见【健新原力】公众号
菜单栏-关于我们-资源下载
欢迎点击查看
健新原力是专注于先进治疗药物(ATMP)的CDMO企业,致力于提供高质量端到端的质粒、RNA、LNP、外泌体、病毒载体、细胞治疗等解决方案。我们的先进车间符合FDA、EMA、NMPA的cGMP标准,并采取严格的政策和措施以保护客户知识产权。管理团队拥有丰富的行业经验,在美国、欧洲和中国已成功领导多个创新药从开发到商业化全流程。健新原力在工艺开发和生产方面拥有专业知识和丰富经验,致力于加速全球创新药的开发和商业化,是您值得信赖的合作伙伴。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论