一.心脏和AAV简介
在大多数实验研究和基因治疗中,能够实现目标基因的组织特异性表达是首选方案。以前将基因表达限制在心肌上的努力通常依赖于直接注射到心肌或冠状动脉内灌注,但是用于心脏基因递送的理想载体应具备如下优势:有效且特异性地将基因递送至心肌细胞,提供长期的基因表达,无免疫反应,对宿主构成最小的风险,并且尽量可以在没有复杂外科手术的情况下给药到心脏。
重组AAV病毒载体恰好具备上述优点,并已被在科研和基因疗法中广泛应用。AAV具有不同的血清型和启动子,针对不同的组织器官选择合适的血清型搭配特异性启动子,可进行靶向高效感染。下文将详细介绍AAV在心脏和血管研究中的使用策略。
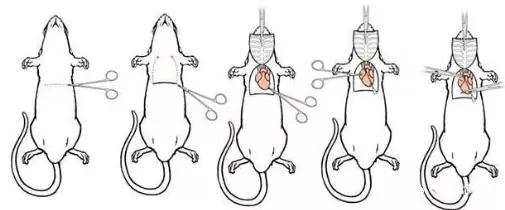
图1. 小鼠心脏注射图示(来源于网络)
二、血清型和启动子推荐
2.1 血清型选择
根据文献报道,不同的AAV血清型具有不同的衣壳蛋白空间结构,识别不同的细胞表面受体,表现为不同的组织亲嗜性。AAV1、AAV2、AAV6、AAV8和AAV9型等均被体内验证过,对心脏有较高的感染效率,目前靶向心肌首选AAV9血清型。
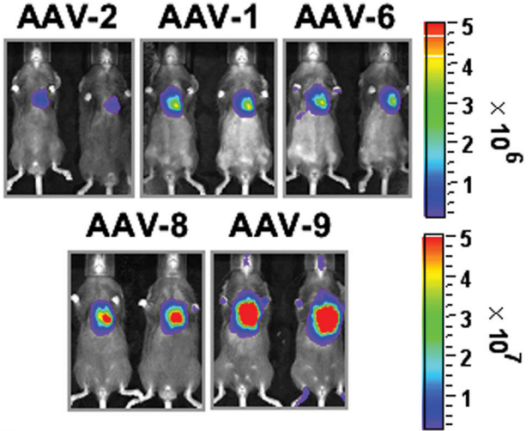
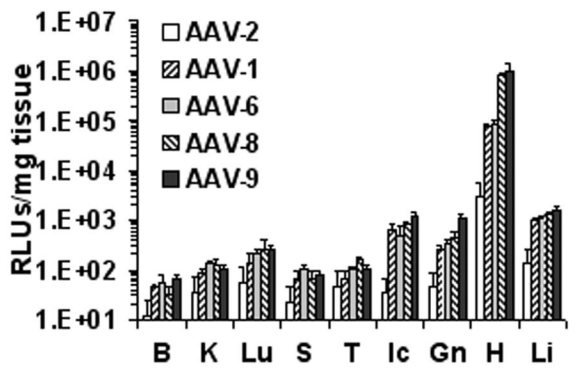
图2(原文FIG2). 生物发光成像比较了五种AAV血清型的心肌细胞特异性。AAV 血清型(AAV-2、AAV-1、AAV-6、AAV-8 和 AAV-9)。1周龄小鼠(每组N=4只)通过颈静脉注射AAV剂量为1×10^11VG/只。(A) 给药后第 28 天获得的体内生物发光图像。(B)其他组织的荧光素酶表达强度分析(大脑,B;肾,K;脾脏,S;胸腺,T;肋间肌,Ic;腓肠肌,Gn;肝脏,Li;心脏,H)。结果显示,AAV8和AAV9对心脏的感染效率均高于其他血清型,并且AAV9的扩散性高于AAV8。[1]
血管方向的研究中,常用血清型除了具有广泛组织嗜性的AAV1、5、9以外,吉玛还可以提供更具血管内皮靶向性的AAV血清型:AAV-Vec、AAV2-QuadYF和AAV-BI30。[2,3]
2.2 启动子推荐
哺乳动物的心脏主要由心肌细胞和非心肌细胞构成。其中30%是心肌细胞,70%是非心肌细胞;而心肌成纤维细胞约占非心肌细胞总数90%;除心脏以外,也有很多研究针对心血管方向。吉玛可提供cTNT、POSTN、mTie、SM22a、CD68等心血管研究常用的组织特异性启动子。[4]

表1. 心血管研究常用组织特异性启动子
三.注射方法选择
AAV靶向心脏的递送方式主要包括系统性注射、原位注射和冠脉注射等,目前文献报道较多的是原位注射(心肌原位注射)和系统性注射(尾静脉注射)。
向血管递送AAV的方式主要有系统性注射(尾静脉注射)、原位注射(结扎法和凝胶孵育),对于脑血管感染还可以采用脑立体定位注射。

表2. 心脏和血管常见注射方案汇总
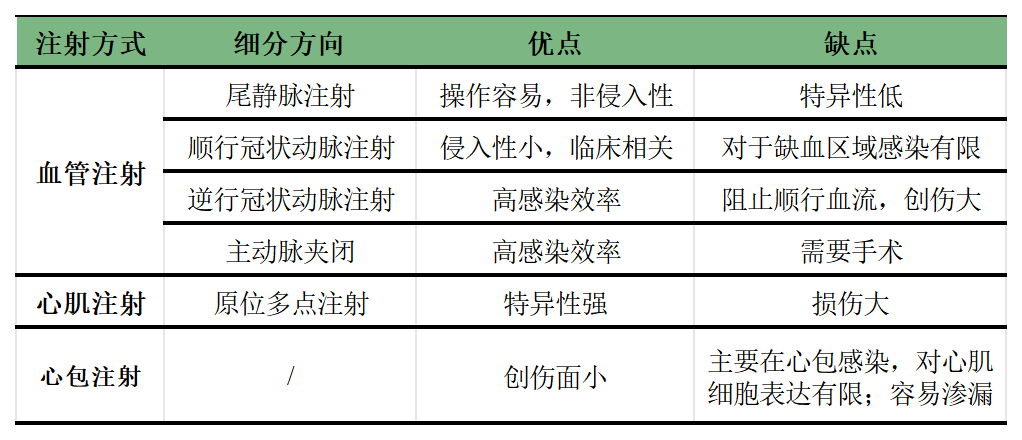
表3. 不同AAV注射方式的优缺点对比
以小鼠为例,介绍心肌原位注射方法。
更多操作细节,可以参考以下文献提供的视频(左下角阅读原文直达)
视频网址:https://app.jove.com/v/2581/coronary-artery-ligation-and-intramyocardial-injection-in-a-murine-model-of-infarction
This is adapted from Virag, J. A., Lust, R. M. Coronary Artery Ligation and Intramyocardial Injection in a Murine Model of Infarction. J. Vis. Exp. (52), e2581, doi:10.3791/2581 (2011).
小鼠心肌梗死模型的冠状动脉结扎和心肌内注射,主要操作步骤如下(由左向右观看):
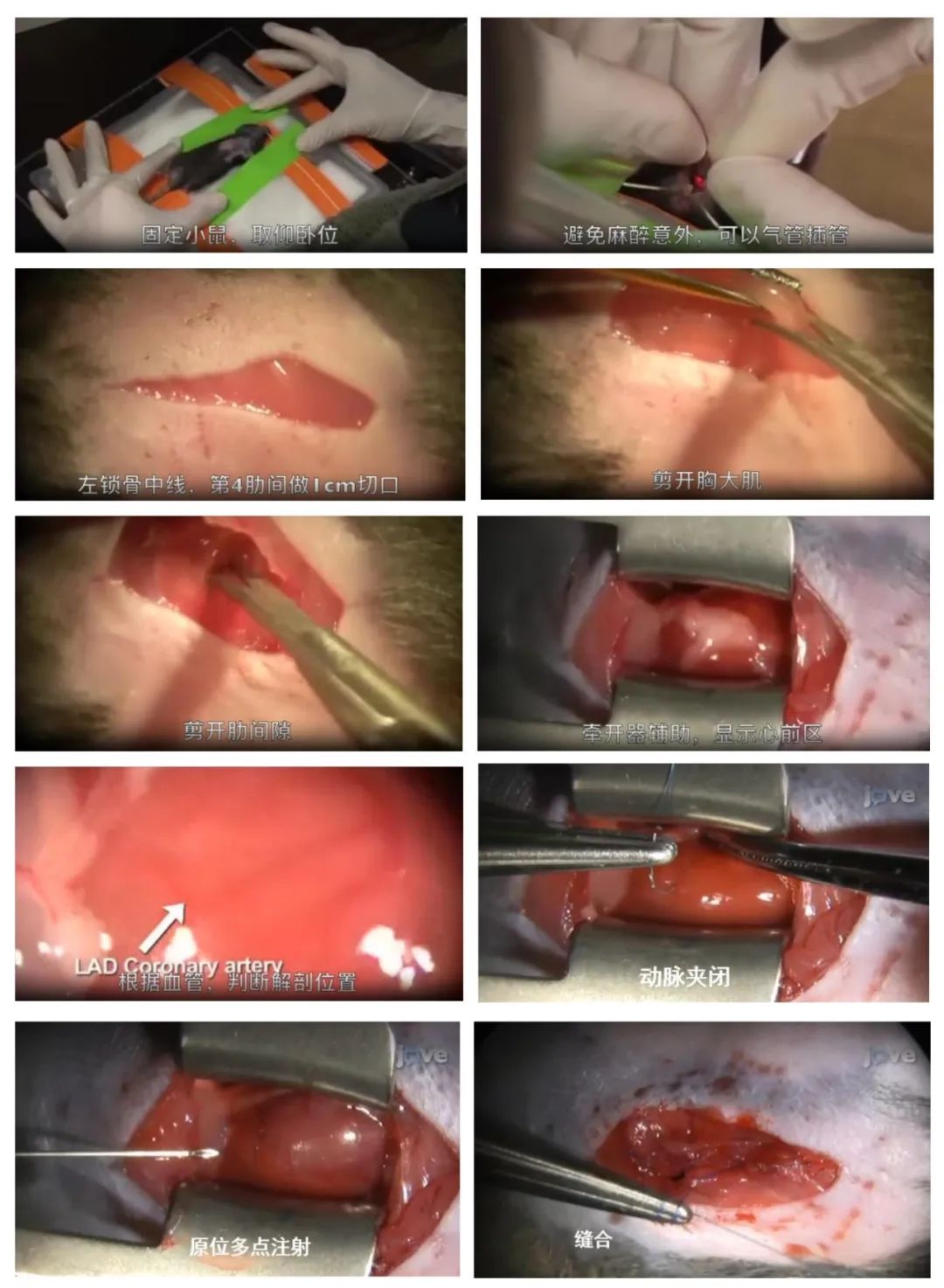
对于心肌注射,通常使用带有无菌30号斜针的Hamilton注射器。当注射操作完成后,肋骨、胸肌和皮肤被依次缝合。线阻滞镇痛是通过在皮肤缝合前将0.25%的普鲁卡因溶解在无菌盐水中施加到肌肉层来实现的。给小鼠皮下注射生理盐水,并将其置于加热室中,直到它们胸骨横卧。然后,它们被送回鼠笼,在标准条件下饲养,直到组织采集。
文献案例


图3. CMV和cTNT在心脏表达的特异性比较[1]
病毒:rAAV/9-cTnT/CMV-luciferase
注射方式: 颈静脉注射
动物模型: 1周龄小鼠
表达时间:4周
注射剂量:1×10^11 VG/mouse
结果显示,心脏表达的特异性cTNT>CMV。
吉玛案例

图4. AAV9-cTnT-eGFP尾静脉注射感染心肌冷冻切片荧光成像
病毒:AAV9-cTnT-eGFP-3*flag
注射方式: 尾静脉注射
动物模型: 6周龄小鼠
表达时间:8周
注射剂量:2×10^11 VG/mouse
切片方式:冷冻切片
结果显示AAV9-cTnT-eGFP-3*flag通过尾静脉侵染心脏后8周,心肌组织冷冻切片可以直接荧光观测到eGFP,信号较强。
四、参考文献
[1] Prasad KM, et al. Robust cardiomyocyte-specific gene expression following systemic injection of AAV: in vivo gene delivery follows a Poisson distribution. Gene Ther. 2011 Jan;18(1):43-52. doi: 10.1038/gt.2010.105. Epub 2010 Aug 12.
[2] L.Zhang,et al.Capsid Engineering Overcomes Barriers Toward Adeno-Associated Virus Vector-Mediated Transduction of Endothelial Cells. Hum Gene Ther. 2019 Sep;30(10):1-46. doi:10.1089/hum.2019.027.
[3] Krolak T,et al. A High-Efficiency AAV for Endothelial Cell Transduction Throughout the Central Nervous System. Nat Cardiovasc Res. 2022 Apr;1(4):389-400. doi:10.1038/s44161-022-00046-4.
[4] Lindsley A,et al. Identification and characterization of a novel Schwann and outflow tract endocardial cushion lineage-restricted periostin enhancer. Dev Biol. 2007 Jul 15;307(2):340-55. doi: 10.1016/j.ydbio.2007.04.041.
























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论