文章来源:生物世界
嵌合抗原受体T细胞疗法(CAR-T)作为一种单独疗法或与其他疗法联合使用,正在广泛研究用于各种实体瘤、血液系统恶性肿瘤和自身免疫性疾病的治疗。目前,美国FDA已批准6款CAR-T细胞疗法上市,其中4款靶向CD19,用于治疗B细胞白血病和淋巴瘤,2款靶向BCMA,用于治疗多发性骨髓瘤。
BCMA在成熟B淋巴细胞中优先表达,而在造血干细胞或非造血组织中表达极少。它在骨髓浆细胞的存活中发挥关键作用,而对整体B细胞稳态没有显著影响,并且是多发性骨髓瘤中恶性浆细胞的重要标志物。
BCMA CAR-T细胞在经过大量预处理的多发性骨髓瘤患者中展示出显著疗效,研究报告总缓解率为80%,然而,该疗法在反应持续时间方面仍存在着巨大挑战。例如,接受BCMA CAR-T细胞疗法Abecma治疗的多发性骨髓瘤患者中,有一半在一年内出现了疾病复发。值得注意的是,大多数复发患者仍显示BCMA阳性,这表明抗原丢失并不是复发背后的主要机制。因此,还需要进一步探索提高CAR-T细胞持久性的方法。
2024年7月30日,Dana-Farber癌症研究所、哈佛医学院的研究人员在 Nature Biotechnology 期刊发表了题为:A CAR enhancer increases the activity and persistence of CAR T cells 的研究论文。
研究团队开发了一种CAR增强子(CAR enhancer,CAR-E),通过将BCMA抗原与低亲和力IL-2融合,从而选择性地在CAR-T细胞中诱导IL-2信号转导,在降低IL-2相关毒性的同时,增加了CAR-T细胞的增殖、肿瘤细胞的清除以及记忆CAR-T细胞的发育,还能有效防止肿瘤复发,在更低CAR-T细胞剂量下增强CAR-T细胞的功能和持久性。

目前已经开发了几种策略来增强CAR-T细胞的活性和持久性,包括:
1)共刺激结构域的选择,例如4-1BB、CD28或它们的组合;
2)使用基因组编辑技术来调控耗竭或激活通路;
3)使用诱导系统为CAR-T细胞配备表达细胞因子及其受体(例如IL-7、IL-12、IL-15或它们的组合);
4)使用开关构建体,其特征是设计用于结合抑制分子(例如IL-4)的受体,而细胞内结构域被设计用于诱导T细胞适应性(例如IL-7内结构域);
一种有趣的方法使用了正交IL-2和IL-2受体(IL-2R)系统,优先将正交的IL-2递送到经过正交IL-2R改造的CAR-T细胞,已经设计了替代方法来促进CAR-T细胞与树突状细胞之间的相互作用,从而通过树突状细胞提供共刺激。这些多方面的策略前景广阔,但需要对CAR-T细胞进行额外的工程改造步骤,从而带来内在挑战,包括复杂的设计和操作、潜在的免疫原性以及潜在DNA突变风险。此外,对CAR-T细胞的进一步基因编辑修饰可能会加重毒性。因此,尽管研究人员付出了相当大的努力,但这些方法在临床上的应用仍然有限。
为了在不向CAR-T细胞引入额外基因修饰的情况下克服上述限制,该研究开发了基于抗原的CAR增强子(CAR enhancer,CAR-E)。
这种方法涉及将目标抗原(例如BCMA)与低亲和力的增强子(例如 IL-2)融合,从而能够精确靶向CAR-T细胞,并有助于在输注后优先递送免疫调节剂。研究团队选择了细胞因子IL-2作为增强子,因为它能够促进T细胞的活化并增强T细胞的抗肿瘤活性。
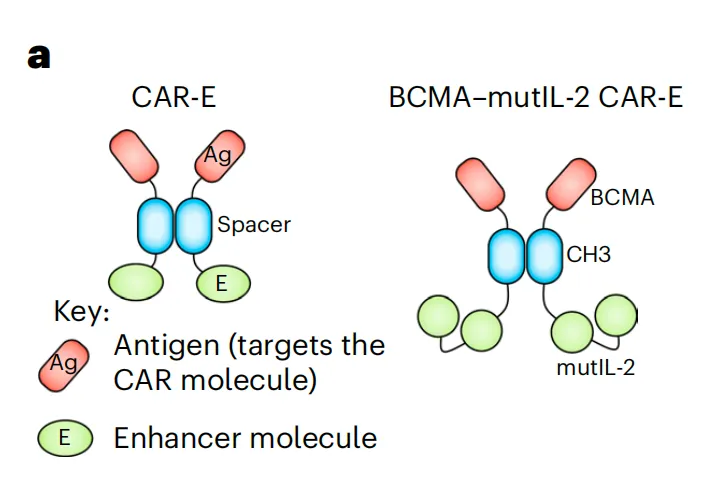
研究团队使用BCMA CAR-T细胞治疗多发性骨髓瘤来展示这一策略,其中CAR-E由与低亲和力IL-2融合的BCMA组成。这在抗原-CAR结合时选择性地在CAR-T细胞中诱导IL-2信号传导,增强T细胞活化和抗肿瘤活性,同时降低IL-2相关毒性。
结果显示,BCMA CAR-E选择性地结合CAR-T细胞,并增加了CAR-T细胞的增殖、肿瘤细胞的清除以及记忆CAR-T细胞的发育。这些记忆细胞在再次刺激时仍保留重新扩增的能力,因此能够有效防止肿瘤复发。机制研究进一步揭示了CAR和IL-2受体的内结构域都参与了CAR-E的作用机制。该研究开发的CAR-E方法避免了对特定工程的需求,并能够以更低的细胞剂量进行CAR-T细胞治疗。
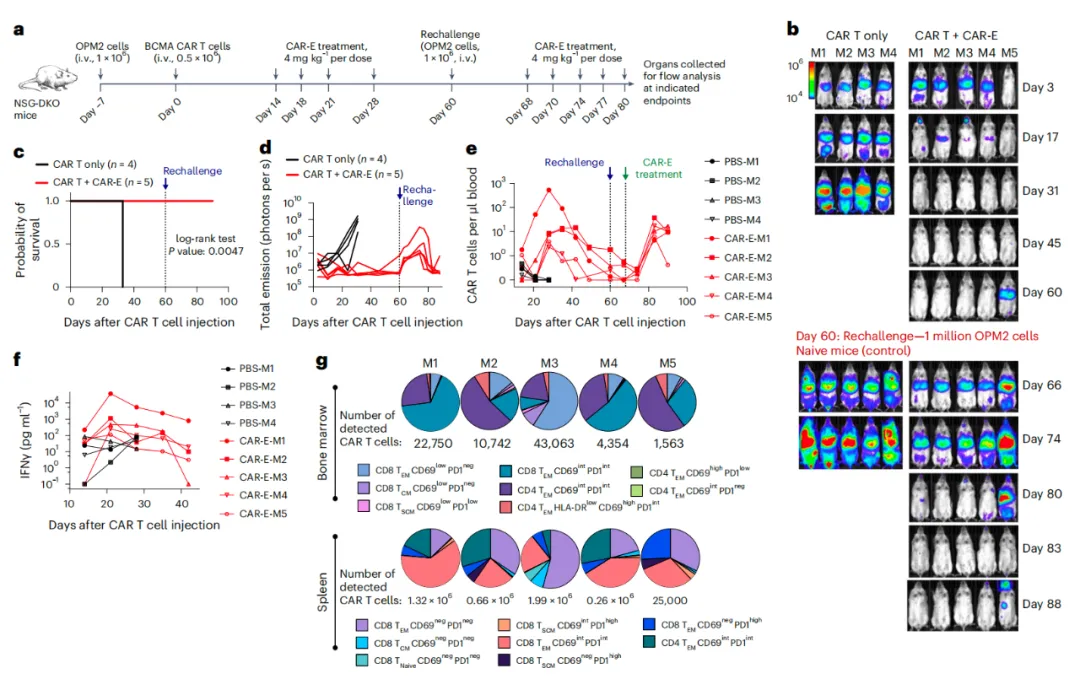
更低剂量的CAR-E仍然有效,持续存在的CAR-T细胞
保留了再次扩增和防止肿瘤复发的能力
总的来说,这项研究表明,CAR-E有选择性地增强了CAR-T细胞的功能和持久性。该方法提供了一种现成的治疗选择,允许优化剂量和治疗方案,以最大程度地减少潜在毒性。
论文链接:
https://www.nature.com/articles/s41587-024-02339-4










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论