

案例概述
案例相关问题调研
病例展示
病例展示

新辅助治疗+手术
1. 2022年09月22日-2023年03月07日完成15次EC-wT方案新辅助化疗。
2. 2023.3.27在全身麻醉下行“1、左侧乳腺癌改良根治术(淋巴结清扫及任意皮瓣)”。
新辅助疗效评估
新辅助治疗反应的评估:(1)M-P分级(3级);RCB级别(RCB-II);免疫组化:浸润癌ER(约40%中等强度+),PR(-),HER-2(2+,50%弱-中等强度完整膜+),Ki-67(约2%+),CD31(见脉管内癌栓)。淋巴结转移癌:淋巴结内癌细胞(约80%中至强+),PR(约5%中至强+),HER-2(2+,约30%弱-中等强度完整膜+),FISH(-),Bi-67(热点区约10-20%+)。
术后PET/CT提示可疑脊柱骨转移,脊柱MR未见异常
辅助内分泌治疗
阿贝西利+依西美坦治疗1年,疾病进展(PD)。
晚期解救治疗及疗效评估
晚期一线:2024.4复查提示MR及PET/CT提示脊柱骨转移,改为瑞波西利+氟维司群。2024.6复查MR、PET提示骨转移进展,完善骨穿刺活检病理示:“腰4椎体肿物”结合病史、形态及免疫组化结果,考虑为转移性乳腺癌。免疫组化:异型细胞CK-pan(+),ER(个别细胞弱+),PR(约30%弱+),CKT(+),CK20(-),GATA 3(+),TTF1(-)、Pax-8(-)。
晚期二线:2024.7行T-DXd 300mg治疗。

专家点评
对于CDK4/6抑制剂治疗进展的患者,判断内分泌治疗的敏感性对于制定后续治疗决策至关重要。临床研究[3]中,内分泌敏感定义为复发转移阶段内分泌治疗达完全或部分缓解或疾病稳定≥6个月,或辅助内分泌治疗≥24个月出现复发转移。本案例患者辅助强化治疗前评估骨转移可能,但是多种影像检查结果不一致,如果按照辅助内分泌辅助治疗12个月进展考虑为原发内分泌耐药,如果为晚期一线接受阿贝西利+依西美坦12个月疾病进展,属于继发耐药,后续可行NGS检测了解有无PAM通路活化或BRCA突变,该患者无NGS检测条件,基于药物可及性,参考MAINTAIN研究、postMONARCH研究结果,遂继续尝试更换CDK4/6抑制剂及内分泌药物的治疗。并且根据CSCO乳腺癌指南[2],对于CDK4/6抑制剂治疗失败患者,可选择另一种CDK4/6抑制剂联合内分泌治疗。本案例患者在既往CDK4/6抑制剂治疗进展后,接受瑞波西利+氟维司群进行跨线治疗似乎合情合理。然而仅仅2个月后,患者骨转移进展。
事实上,在当时的决策背景下,仅有限数据支持CDK4/6抑制剂跨线治疗,其中II期MAINTAIN研究[4]中,CDK4/6抑制剂+ET对于既往CDK4/6抑制剂经治患者的无进展生存期(PFS)改善并不显著(5.29个月 vs 2.76个月,HR=0.57,P=0.006);其他相关研究仅为单臂临床试验,循证证据级别相对较低。尽管目前III期postMONARCH研究[5]已经披露阳性结果,但CDK4/6抑制剂跨线治疗的PFS绝对获益仅为0.7个月(6.0个月vs 5.3个月,HR=0.73,p=0.02)。这也提示,未来研究中CDK4/6抑制剂治疗再挑战的临床获益仍需进一步探索。
两线内分泌治疗进展属于内分泌难治人群,根据NCCN指南[6],ADC或化疗可作为其后续治疗方案。在DESTINY-Breast04(DB04)研究[7]中,纳入88.7%的HR+/HER2低表达晚期乳腺癌患者,这类患者均为内分泌难治,且其中超过70%的患者既往接受过CDK4/6抑制剂治疗。结果显示,T-DXd的中位PFS长达10.1个月,近2倍于化疗组(5.4个月,HR=0.51),中位总生存期(OS)长达23.9个月,较化疗组(17.5个月,HR=0.64)改善约6个月,并且客观缓解率(ORR)高达52.6%,是化疗组16.3%的3倍多。亚组分析显示,CDK4/6抑制剂经治人群具有一致获益趋势,其中位PFS是化疗组的近2倍(10.0个月 vs 5.4个月,HR=0.55)[8]。基于该研究成果,国内外权威指南一致推荐T-DXd作为HER2低表达晚期乳腺癌标准治疗。
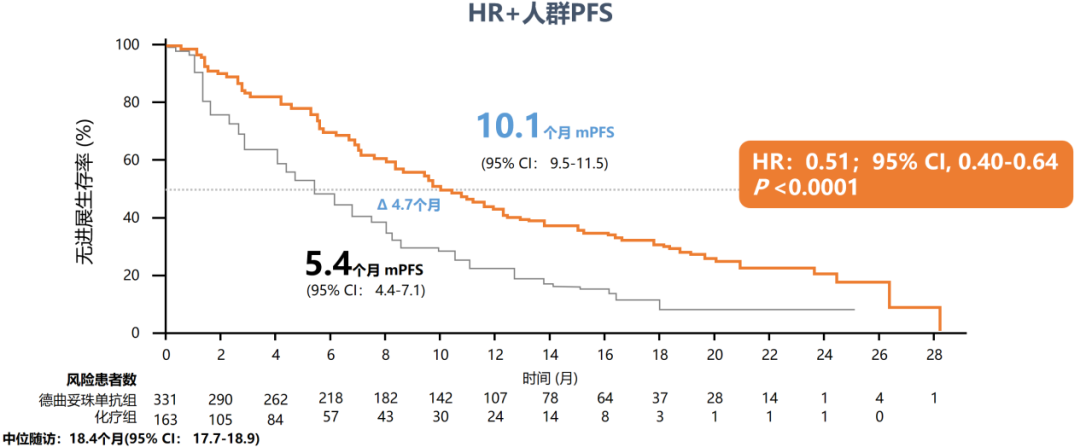
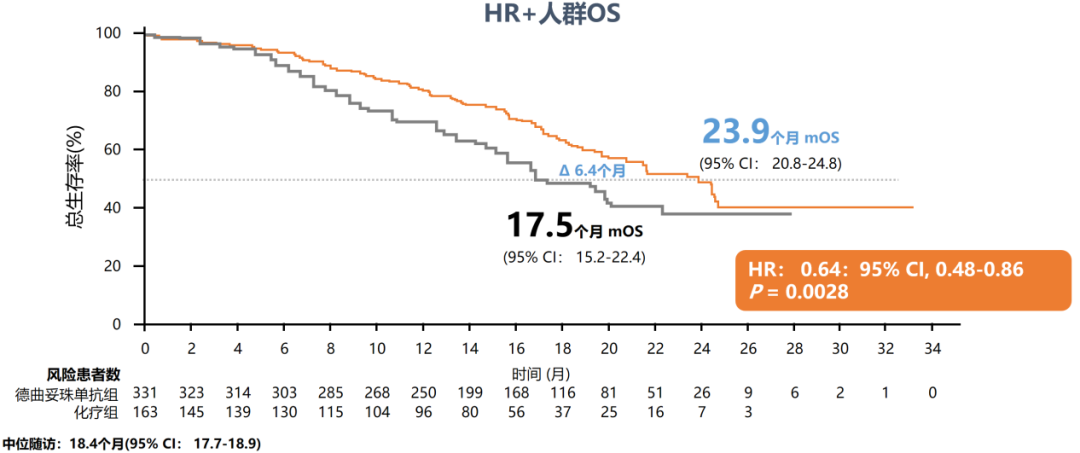
图1. DB04研究HR+/HER2低表达人群的PFS和OS数据
DESTINY-Breast06(DB06)研究[9]旨在探索T-DXd与化疗对HR+/HER2低表达或HER2-ultralow(IHC 0伴有膜染色)晚期乳腺癌的疗效和安全性。研究入组了84.9%在转移性疾病阶段接受过≥2线内分泌±靶向治疗和大约89%的CDK4/6抑制剂经治患者。在主要试验人群,即HR+/HER2低表达(IHC 1+或IHC 2+/ISH-)患者中,与化疗组相比,T-DXd组在PFS方面表现出统计学显著且具有临床意义的改善(13.2个月 vs 8.1个月,HR=0.62,P<0.0001)。并且既往接受过2线内分泌±靶向治疗(13.1个月 vs 8.3个月,HR=0.69)和CDK4/6抑制剂经治(13.1个月 vs 7.9个月,HR=0.61)亚组获得了与该队列总人群一致的获益趋势。尽管截至分析时,OS数据尚未成熟(40%成熟度)。但相比化疗组,T-DXd在HER2低表达(HR=0.83,P=0.1181)人群中已显示出积极的OS获益趋势。此外,T-DXd组的ORR近乎于化疗组的两倍(56.5% vs 32.2%)。这些研究成果均为T-DXd用于HR+/HER2低表达晚期乳腺癌提供了重要的循证支持。


图2. HER2低表达人群经BICR评估的PFS
本案例患者在CDK4/6抑制剂跨线治疗后疾病再次进展,后续接受T-DXd治疗是明智的选择,该案例能够从真实世界角度验证T-DXd针对两线内分泌经治HR+/HER2低表达晚期乳腺癌患者的治疗获益,为临床实践提供更多证据参考。并且值得思考的是,在T-DXd治疗进展后,可以考虑化疗作为后续用药选择,这种治疗模式有效延迟了患者至接受后续化疗的时间,有助于优化疾病的全程管理,进一步提高患者的生存获益。
病例提供者简历
余少康 教授
北京大学深圳医院 肿瘤内科 主治医师
广东省医疗行业协会乳腺肿瘤管理分会委员
广东省基层医药学会乳腺癌专业委员会委员
深圳市肿瘤多学科防诊治专业委员会乳腺癌青年学组秘书
深圳市抗癌协会靶向治疗与个体化治疗专业委员会常务委员
深圳市抗癌协会化疗专业委员会委员
点评专家简历
农巧红 教授
北京大学深圳医院肿瘤内科 副主任医师
广东省医师协会乳腺专业委员会青年委员
广东省医疗行业协会乳腺内科管理分会副主委
深圳市医学会乳腺病青委副主委
深圳市医师协会乳腺专科医师分会常务理事
深圳市抗癌协会化疗专业委员会常委兼秘书
深圳市健康管理协会肿瘤多学科防诊治专委会乳腺癌青年学组组长

ADC Academy Online
ADC Academy Online是聚焦于抗体偶联药物的学术交流平台。平台紧跟相关领域的最新进展,致力于促进相关专业人士的科学交流和继续医学教育。






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论