环状RNA(circRNAs)是通过剪接过程形成的共价封闭单链RNA分子。大部分的真核circRNA不编码蛋白质,但在基因表达调控中具有潜在影响。然而,部分内源性circRNA具有内部核糖体进入位点(IRESs),可以作为蛋白质模板,并以不依赖于帽的方式被诱导翻译。此外,也可以在体外通过体外转录反应制备大量的circRNA。
circRNA在免疫系统的调节中的潜在作用已被广泛报道。它们由于其共价闭环结构和没有5'帽或3'polyA尾,比线性RNA更稳定,且可以通过细胞外囊泡从细胞中释放出来。这些特性使得它们可以作为诊断和预后的生物标志物,在临床实践中得到应用。
近期,作为疫苗候选,由circRNA开发的疫苗在非人类灵长类动物中被证明可以引发对SARS-CoV-2的广谱保护。然而,circRNA在体内被识别、被翻译以及激活保护性免疫的机制还不清楚。
去年,斯坦福大学Howard Y. Chang教授课题组在《PNAS》发表了名为"Circular RNA vaccine induces potent T cell responses"的文章。文章指出,相比线性mRNA,环状RNA更稳定,能提供持续的蛋白表达。通过用体外制备的能编码蛋白抗原的circRNA对小鼠进行免疫,可以诱导树突状细胞的先天激活,刺激淋巴结和组织中强大的抗原特异性CD8 T细胞反应。这些结果揭示了circRNA疫苗在刺激组织中先天免疫和T细胞反应上的潜在应用,作为治疗性疫苗,可以诱导强大的细胞免疫来清除肿瘤。这些发现表明,体外制备的circRNA可以用于疫苗开发和肿瘤治疗。
circRNA与可溶性蛋白结合可以在多种免疫途径中作为优秀的疫苗佐剂
佐剂可以通过不同的方式增加免疫反应的强度和持久性,对于提高疫苗的效果至关重要。研究表明,外源性circRNA在体内与可溶性蛋白一起传递时,可以帮助诱导抗原特异性抗体和T细胞。但由于递送途径的不同可能会有不同的结果,作者进一步通过不同的免疫途径评估了circRNA作为疫苗配方中一种独特佐剂的潜力。
通过三种递送策略(皮下、鼻内和静脉注射)将体外合成的circRNA和鸡卵清蛋白(称为OVAp)免疫给C57BL/6小鼠,并加以阳性对照(AddaVax,皮下佐剂)辅助验证。在第7天和第30天测量了脾脏、引流淋巴结(LNs)和肺部T细胞和抗体反应的大小。结果发现,无论哪种免疫途径,circRNA+OVAp都能诱导强烈的T细胞反应,效果优于阳性对照。免疫后的抗体检测发现,所有给药途径中观察到的血清中抗ovaIgG抗体的水平都相似。
此外,比较circRNA和Poly(I:C)作为鼻内佐剂的免疫效果发现,circRNA和Poly(I:C)诱导的肺部抗原特异性CD8 T细胞的频率相当。总的来说,研究结果表明,circRNA可以作为一种有效的疫苗佐剂应用于多种免疫途径,并且可以与Poly(I:C)和AddaVax的免疫反应相媲美。
circRNA注射到小鼠体内时,可激活先天免疫细胞,并诱导树突状细胞的免疫激活
在免疫反应的规模、效果和持久性上,先天免疫系统扮演着关键角色。研究者们解析了接种circRNA后强烈的适应性免疫反应背后的生物机制。
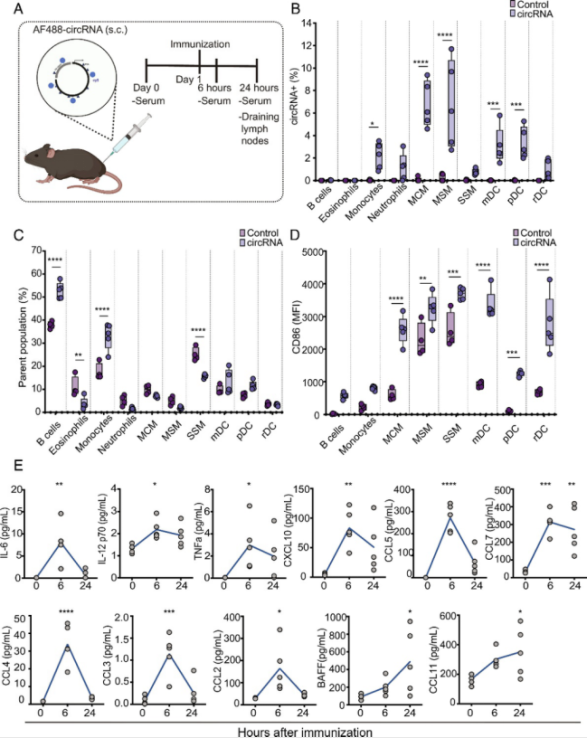
首先,他们确定了circRNA在体内传播时的生物学分布。在接种circRNA前后,他们使用Luminex先天免疫细胞因子面板对血清进行了分析。他们将circRNA与荧光团AF488结合,然后皮下注射(s.c.)AF488-circRNA到C57BL/6小鼠。接种24小时后,他们通过流式细胞分析技术分析了引流到腹股沟淋巴结(iLNs)的先天免疫细胞亚群。结果显示,circRNA在单核细胞、树突状细胞和某些巨噬细胞亚群中被检测到。这些巨噬细胞亚群包括边缘脊髓巨噬细胞(MCMs)、边缘窦巨噬细胞(MSMs)和囊膜下窦巨噬细胞(SSM),其中circRNA在MCMs和MSMs中显著富集。
尽管在小鼠的B细胞中没有检测到circRNA,但B细胞的数量明显升高,CD86的上调显示B细胞的激活也增加,同时,单核细胞的数量和活性显著增加,所有的巨噬细胞和树突状细胞亚群的激活也显著增加,而且血清中的炎症免疫因子对circRNA接种的反应也非常强烈。从这些结果可以看出,当circRNA被注射到小鼠体内时,它会诱导多种先天免疫细胞的激活,并引发炎症细胞因子的强烈反应。
树突状细胞(DCs)是最有效的抗原递呈细胞,它们负责处理和递呈抗原、细胞迁移以及T细胞的共刺激。研究者发现,circRNA能够诱导树突状细胞的成熟,进而增强共刺激分子的表达和多种炎症细胞因子以及趋化因子的分泌。
CAR-T传递工程化的circRNA改善了蛋白编码以及抗原呈递
以往研究已证实了circRNA能够激活先天免疫。本研究进一步探讨了其作为佐剂和抗原编码序列时,诱导适应性免疫反应的能力。
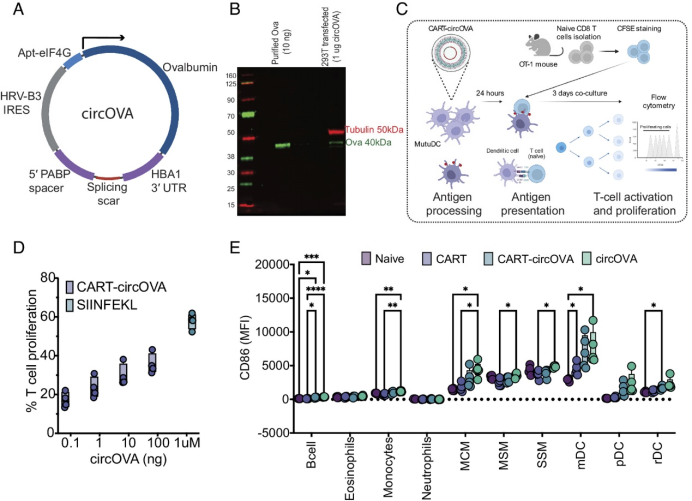
研究者使用优化的元件设计和转录了编码鸡卵清蛋白的circRNA(名为circOVA),目的是使circRNA的翻译效果超过mRNA。在体外细胞实验中,他们证明了circOVA具有翻译能力。
研究者使用CAR-T(一种合成的可降解材料)来递送circRNA,这种材料可以在细胞内复杂、保护并高效地递送mRNA和circRNA,从而产生高效的蛋白质翻译。CAR-T-circOVA的转染结果表明,由circRNA编码的蛋白质可以被树突细胞加工并呈现给免疫系统。
在使用CAR-T、circRNA或CAR-T-circRNA免疫小鼠后,他们发现CAR-T传递的circRNA导致了先天免疫亚群的激活谱,这与之前观察到的circRNA的效果相似。这些发现进一步证实了circRNA在激活并诱导适应性免疫反应中的重要作用。
circRNA编码的抗原在体内诱导强烈的T细胞反应
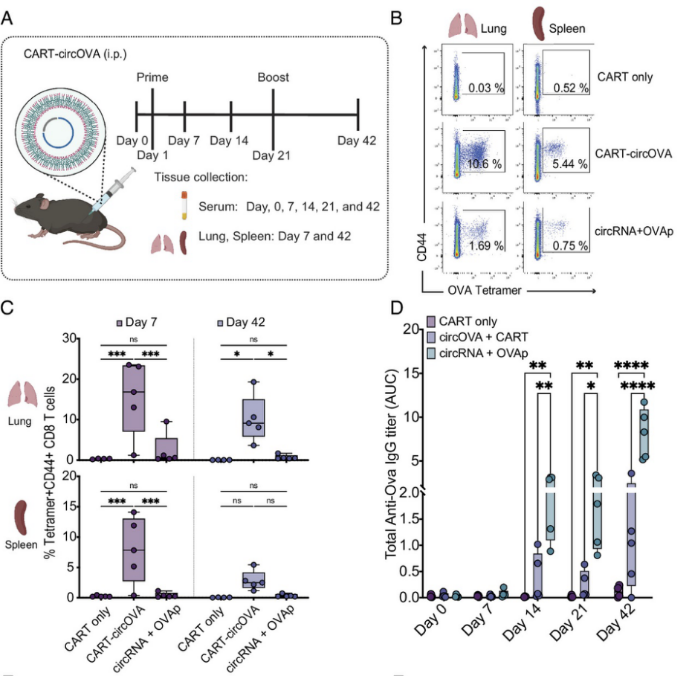
CAR-T已被证明具有优秀的包封效率、良好的耐受性和非免疫原性。研究者还确认了CAR-T递送circRNA可以产生稳定和持久的蛋白质(通过腹腔注射)。因此,他们在circRNA上进行了进一步的验证。结果显示,CAR-T-circOVA在肺、脾和血液中诱导了有效的CD8 T细胞反应,这是circRNA+OVAp的6-8倍。在抗体反应检测中,circRNA+OVAp诱导的抗OVA IgG一致且显著提高,而在CAR-T-circOVA组仍可检测到抗OVA抗体。缺少一致的抗体反应可能是因为CAR-T-circOVA免疫后蛋白质的分泌减少,这与免疫24小时后血液中无法检测到OVA蛋白质的结果一致。这些结果表明,CAR-T-circRNA免疫策略导致了T细胞偏倚的反应,可能需要进一步优化以诱导对circOVA的抗体反应。
接下来,研究者尝试确定circRNA和CAR-T的组合是否可以推广到其他候选疫苗。流感病毒是变异速度最快的病毒之一,针对病毒的保守位点(如核蛋白)的CD8 T细胞已被证明具有保护异亚型流感感染的效果。因此,他们构建了一个编码流感病毒(PR8株)核蛋白(NP)序列的circRNA,称为circNP。结果显示,腹腔注射circNP+CAR-T(CART-circNP)后,在血液中诱导了核蛋白特异性T细胞反应。这些结果揭示了,利用circRNA编码病原体源的抗原序列可以有效地诱导抗原特异性CD8 T细胞应答。
circRNA疫苗可诱导抗肿瘤疗效
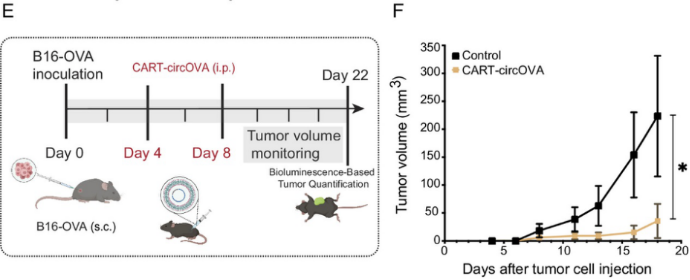
癌症疫苗接种的目标是诱导基于抗原特异性T细胞的细胞免疫,以便靶向并消除肿瘤细胞。在使用circOVA与CAR-T复合物免疫后,研究者在组织和血液中观察到了强烈的T细胞反应,这表明circRNA可以作为一种癌症疫苗。
研究者在小鼠治疗方案中测试了circRNA疫苗的抗肿瘤效果。他们将B16-F10-OVA黑色素瘤细胞接种在小鼠的背部皮下,以构建肿瘤模型,然后将小鼠随机分为两组:对照组(未接受治疗)和CAR-T-circOVA(疫苗)组。结果显示,与未接受治疗的组相比,接种circRNA疫苗的组表现出明显的肿瘤生长抑制效果。这些结果表明,circRNA免疫可以作为一种有效的抗肿瘤治疗策略。
我们的IVT-mRNA生产解决方案简化了您的工作流程,从序列设计到线性mRNA和环状mRNA的合成,再到LNP配方和体外检测。我们优化了IVT-mRNA的专有生产平台,确保mRNA的高质量和高表达效率。
环状mRNA是一种单链RNA,其5'和3'末端连接形成共价闭合环。环状结构带来了多种功能优势,包括更高的稳定性和更长的表达持续时间。源兴基因使用先进的circRNA技术平台可以快速完成您的研发计划:设计、合成和分析。
一站式解决方案,满足您所有的线性mRNA和circRNA技术服务需求
序列设计:
环状RNA(circRNA)环化优化:
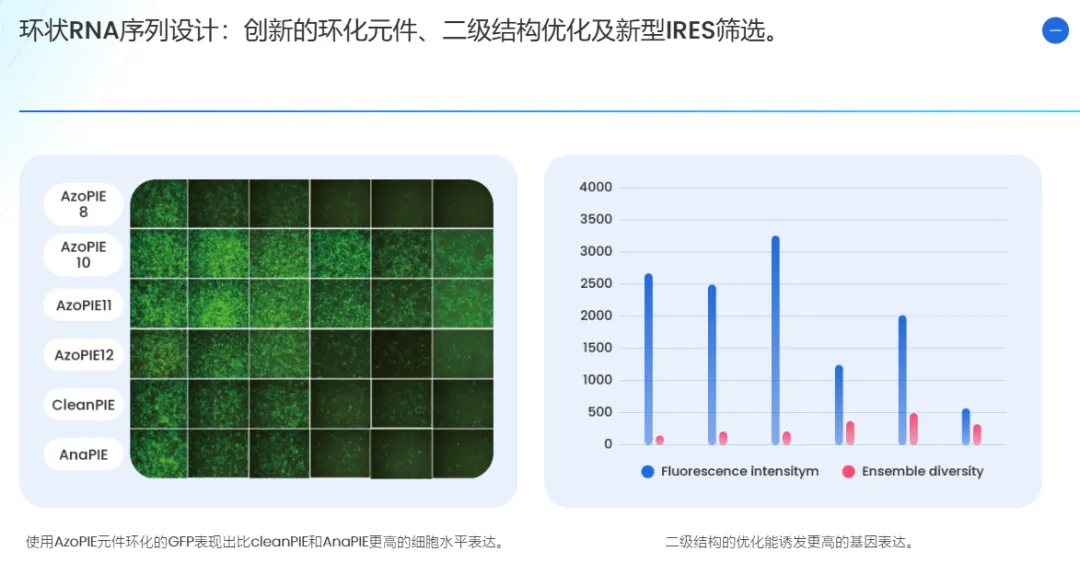
创新环化元件开发
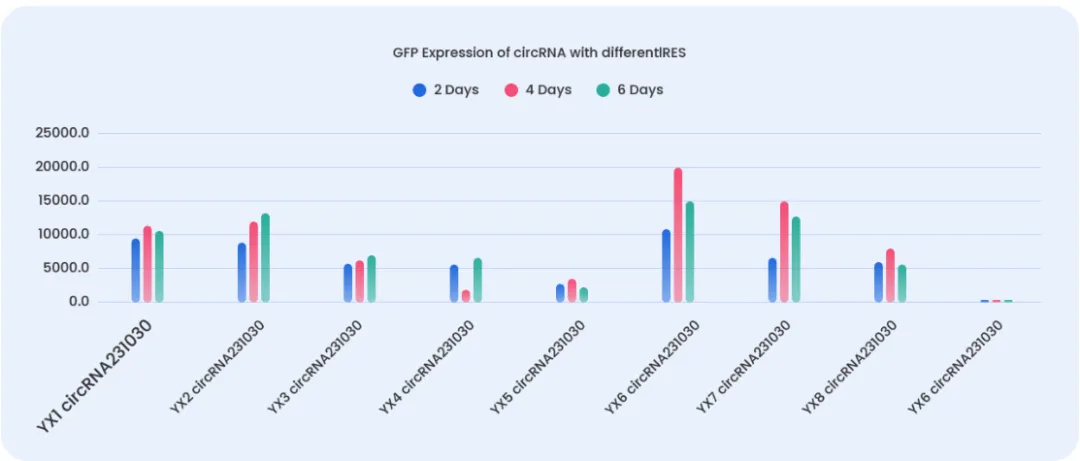
IRES筛选
mRNA UTR优化
目标基因序列设计:
密码子优化
二级结构优化
质粒构建:
规模: 100mg-1g
超螺旋比例: ≥90%
内毒素: ≤ 0.1 EU/μg
线性mRNA和circRNA合成
circRNA
规模: 200ug~ 1g
序列长度: 100bp~ 6k
高纯度:采用HPLC纯化,确保纯度>80%
实验设计优化(DOE):T7酶筛选,纯化方法优化
线性mRNA
规模: 100ug~ 10g
序列长度: 100bp~ 10k
高纯度:采用HPLC纯化,确保纯度>80%
实验设计优化(DOE):T7酶筛选,纯化方法优化
修饰
5’ 帽子: Cap0,Cap1 (共转录法或酶法)
加帽率:>95%
Poly(A) 尾: 120A,或按需定制
修饰核苷酸: N1-Me-Ψ, 5moU, 5meC & Ψ, Cy5-UTP 或 Thio-CTP
环状RNA核苷酸修饰
LNP配方
LNP 脂质库
靶向LNP递送研究
配方研究

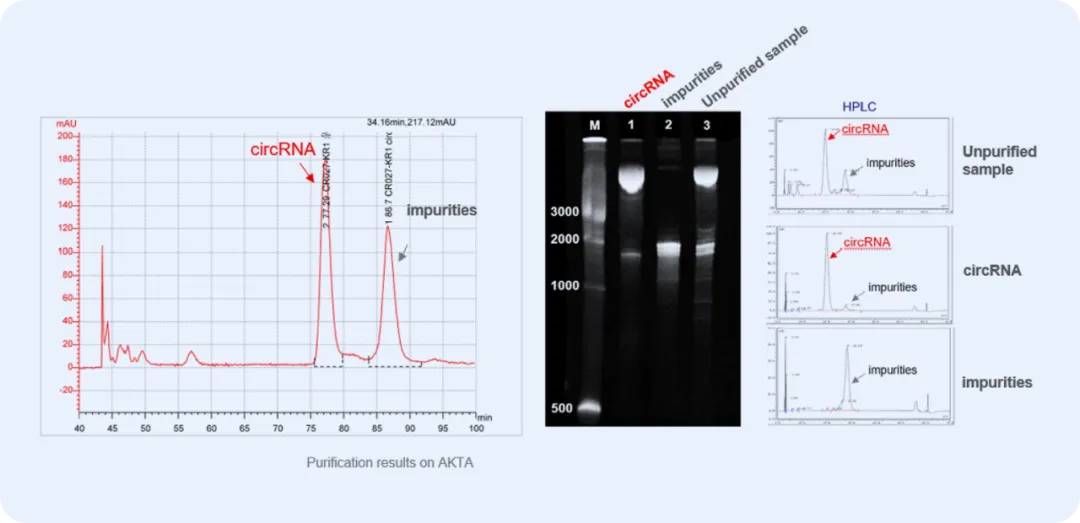
源兴开发出来创新的色谱法,能够有效地分离环状RNA中的杂质





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论