

近日,全球首个肺癌筛查和筛查后肺结节良恶性鉴别诊断管理系统研究ASCEND-LUNG(NCT04817046)相关结果发表于《柳叶刀》旗下子刊eClinical Medicine(影响因子:9.6)[1] 。
ASCEND-LUNG研究历时近4年,致力于基于液体活检多组学和影像组学开发一贯式肺癌筛查和筛查后肺结节良恶性鉴别诊断管理系统。该研究首次头对头评估了cfDNA甲基化、ctDNA突变以及血清肿瘤标志物作为肺癌筛查模型的性能,并探索了不同组学的最优联合模式。同时,该系统还首次实现了液体活检贯穿整个肺癌筛查和筛查后管理过程的高效便捷模式!
目前,低剂量螺旋胸部CT(LDCT)被推荐用于肺癌高风险人群的筛查,但LDCT具有一定放射性,人群依从性不高。据报道,在肺癌高风险人群中,仅3.3%到3.9%接受过LDCT检查[2]。此外,LDCT对肺结节的发现十分敏感,但特异性仍不够理想,因此可能导致肺结节的过度诊断,引起不必要的干预和人群焦虑。目前,迫切需要开发一种新型高效的肺癌筛查和筛查后管理系统来满足以下要求:(1)简单方便以确保高依从性;(2)具有相对较高的灵敏度;(3)能够有效减少接受LDCT筛查者数量;(4)更准确地进行肺结节良恶性鉴别诊断,以最小化不必要的侵入性活检或手术。
液体活检因其无创、安全和方便等优点,具备解决以上问题的天然优势。考虑到不同维度生物标志物来源和释放机制的差异,不同组学之间可能存在一定程度的互补性。因此,整合来自液体活检的多组学特征,或可解决单一组学的限制以提高癌症检测性能。但目前不同组学之间最优的联合方式尚不明确。
此外,约22.9%的肺癌高风险人群在LDCT筛查结果呈阳性,其中约59.6%的人群存在直径大于等于5毫米的肺结节[3]。可见,对肺结节的准确分类也至关重要。利用人工智能(AI)算法从医学图像中提取高通量定量特征的方法可以揭示人肉眼无法识别的微观信息,同时整合液体活检特征,或可进一步优化肺结节良恶性鉴别诊断性能。
为了优化现有的LDCT肺癌筛查路径并提升在LDCT筛查后对肺结节良恶性鉴别诊断的准确性,我们在ASCEND-LUNG研究中通过深入探索不同组学的最优联合模式,开发并验证了一种新型集成液体活检多组学和影像组学的综合管理系统,名为北京大学肺癌筛查和筛查后管理系统(Peking University Lung Cancer Screening and Management System, PKU-LCSMS)。

图1:PKU-LCSMS工作概念图
ASCEDD-LUNG队列前瞻性入组了癌症和良性患者,并根据入组的癌症患者年龄匹配了健康对照人群。所有受试者将采集基线血样进行1)cfDNA甲基化(燃石医学基于酶学方法的甲基化panel检测,共198,713个CpG位点,对应40,359个DMRs,测序深度为1000X,);2)ctDNA突变(燃石医学的168个基因ctDNA panel,ctDNA和配对白细胞测序深度分别为35,000X和1,000X,产品名为朗清,Nature Biotechnology | 全球大型液体活检校验项目结果发表,燃石医学取得亮眼成绩;以及3)16项血清肿瘤标志物检测。
其中癌症和良性疾病患者将同步收集胸部CT影像组学数据,癌症患者同时收集癌和癌旁组织用于多组学检测来进行特征筛选和机制探索,包括1)198,713个CpG位点甲基化panel检测(500X);2)组织DNA突变(燃石医学OncoScreen® 520基因Panel);和3)mRNA表达测序。于2021年2月到2022年3月在北京大学人民医院胸外科入组的患者及匹配的健康对照人群用于模型开发(随机拆分为训练队列和验证队列);于2022年3月到2022年8月在北京大学人民医院胸部肿瘤学研究所和早期NSCLC智能诊疗研究所入组的患者及匹配的健康对照人群用于模型的独立验证(独立验证队列)。
1:建立并验证基于液体活检多组学的肺癌筛查模型
研究首先通过训练队列中癌症患者的癌和癌旁组织甲基化数据,筛选出肺癌特异性甲基化特征,最终确认了共1,583个DMRs,用于进一步建立基于血液cfDNA甲基化的高敏感性肺癌筛查模型。通过对cfDNA甲基化、ctDNA突变和蛋白这三个单一组维度以及不同组学联合的方式进行评估,发现基于cfDNA甲基化联合蛋白组学的形式(AUC 0.963;[95%CI,0.942-0.984])和三个组学联合(AUC 0.969; [95%CI,0.94-0.90])最优,两者无显著统计学差异。鉴于突变带来的额外获益有限且增加更多成本,我们最终选择基于cfDNA甲基化联合蛋白的方式作为肺癌筛查模型的两大组学维度。在独立验证队列中,该肺癌筛查模型表现出99.2%的敏感性和56.3%的特异性,尤其在早期肺癌中具有极高敏感性(I期100%;II期100%)。该液体活检多组学肺癌筛查模型具有较强的普适性和实用性,或可作为LDCT之前的预筛步骤,这将意味着在基本不发生癌症漏诊的前提下,有一半左右的个体可以避免LDCT检查。


2:建立并验证基于AI算法的肺结节良恶性鉴别诊断模型
研究利用影像组学数据联合5个DMRs开发了基于AI算法的肺结节良恶性鉴别诊断模型,在独立验证队列显示出较好的性能(AUC 0.798;[95%CI, 0.694-0.902])。经过头对头比较,基于AI算法的肺结节良恶性鉴别诊断模型可以使81.1%的癌症患者获得及时的诊断和治疗,76.0%的良性疾病可避免侵入性活检或手术,仅0.8%癌症患者被归类为低风险进入每年随访,该结果优于传统的VA模型、Mayo模型以及临床专家的人工判读。该肺结节良恶性鉴别诊断模型使用的5个DMRs中,有4个DMRs被用于肺癌筛查模型。
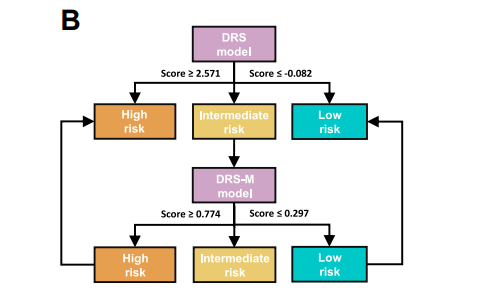
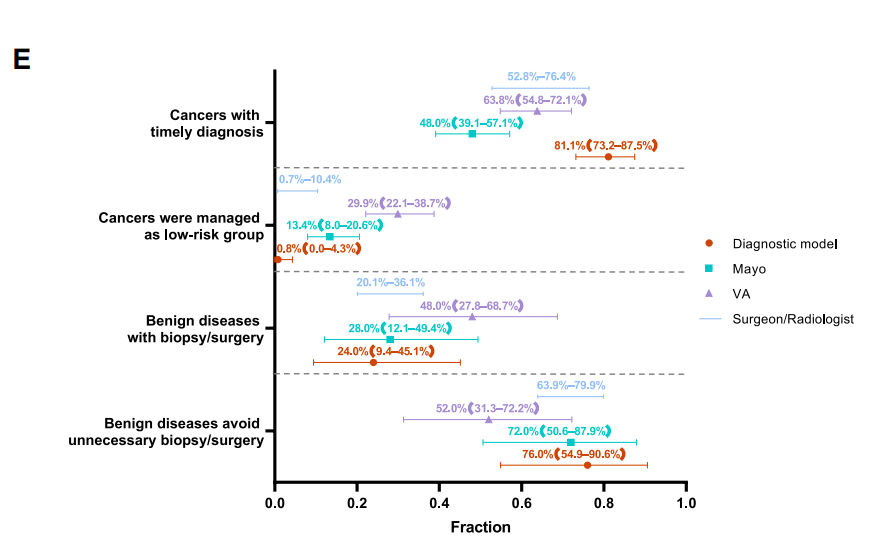
图3:基于AI算法的肺结节良恶性鉴别诊断流程图;基于AI算法的良恶性鉴别诊断模型性能优于传统的VA模型、Mayo模型以及临床专家的人工判读。
3:组织多组学机制探索分析
研究进一步探索了ctDNA shedder和non-shedder癌症人群之间的甲基化差异,发现了两者之间不同的高甲基化和低甲基化特征。如上文提到,在肺癌筛查模型和肺结节良恶性鉴别诊断共用了4个DMRs,这4个DMRs在癌和癌旁组织的DNA甲基化水平具有显著差异,且对应基因的mRNA表达水平均亦具有显著差异,并与notch信号通路、hedgehog信号通路及wnt-beta-catenin信号通路的上调相关,与PI3K/AKT/mTOR通路的下调相关。此外,4个DMRs对应的基因mRNA表达与免疫细胞富集相关,提示了免疫激活特征的存在。
在当下以LDCT作为肺癌推荐筛查方式的背景下,PKU-LCSMS系统整合了液体活检多组学和影像组学,为肺癌筛查和肺结节良恶性鉴别诊断的一贯式管理提供了创新性解决思路。通过该系统,在基本不漏检癌症下,可使一半左右的人群避免LDCT检查,并可以为LDCT发现肺结节的人群提供准确、标准的良恶性鉴别诊断,以指导后续干预策略。
该研究是实现肺癌筛查和筛查后管理全流程一体化系统的里程碑研究。在依从性方面,液体活检样本在当地社区医院或家庭访问等情景下即可完成采集。相同的一管血,不仅能够用于肺癌的LDCT前预筛查,还可以用于LDCT筛查后的肺结节人群管理,可以更广泛覆盖人群进行一体化的管理,使整个肺癌筛查和管理流程变得更加高效便利和标准规范。
在癌症诊疗的漫漫长路上,燃石医学将继续坚定用科学守护生命之光的初心,与临床专家共同携手,不断探索技术极限,实现临床价值最大化,为精准医疗高速发展护航。
参考文献:
[1]Yichen Jin, Wei Mu, Yezhen Shi, et al. Development and validation of an integrated system for lung cancer screening and post-screening pulmonary nodules management: a proof-of-concept study (ASCEND-LUNG). eClinicalMedicine 2024;75: 102769.
[2] Wender RC, Brawley OW, Fedewa SA, et al. A blueprint for cancer screening and early detection: advancing screening’s contribution to cancer control. CA Cancer J Clin.2019;69(1):50–79.
[3] Yang W, Qian F, Teng J, et al. Community-based lung cancer screening with low-dose CT in China: results of the baseline screening. Lung Cancer. 2018;117:20–26.
关于燃石医学
燃石医学(伦敦交易所代码/纳斯达克代码:BNR)成立于2014年,公司使命为“用科学守护生命之光”,专注于开发创新可靠、具有临床价值的癌症伴随诊断与早检产品。公司业务及研发方向主要覆盖:1)癌症患病人群精准医学检测;2)全球抗肿瘤药企的生物标志物和伴随诊断合作;3)基于液体活检的多癌种早检。燃石医学于2018年7月获国家药品监督管理局(NMPA)颁发的中国肿瘤NGS检测试剂盒第一证,在体外诊断领域具有里程碑式意义。实验室获得广东省临检中心颁发的 “高通量测序实验室”技术审核,同时获得美国CLIA、CAP和ISO15189实验室质量体系资质认证。公司将继续致力于开发创新可靠的癌症精准检测产品,推动癌症精准医疗领域的发展。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论