

ESCRTs家族蛋白在EVs的生物发生过程中发挥着至关重要的作用,包括货物蛋白的分选、转运、出芽和释放。通常,细胞外囊泡货物蛋白首先被HECT E3泛素连接酶泛素化,然后被ESCRT-0复合体识别,ESCRT-I/II/III引导货物蛋白内吞到腔内囊泡或直接于质膜外出芽释放,最后VPS4复合体催化膜裂解从而释放来自细胞合成的细胞外囊泡。病毒的晚期结构域是在多种逆转录病毒蛋白中发现的一段短而保守的序列,其可通过主动招募ESCRTs家族蛋白,促进病毒颗粒的出芽释放。例如:人类免疫缺陷病毒(HIV)Gag糖蛋白通过其p6晚期结构域中的PTAP基序与TSG101相互作用,并通过LYPXnL基序与ALIX结合;埃博拉病毒(EBOV)的VP40结构域分别通过PTAP和PPEY基序与WWP2和TSG101相互作用。劳斯肉瘤病毒(RSV)的p2b结构域通过PPPY基序与WWP2相互作用。
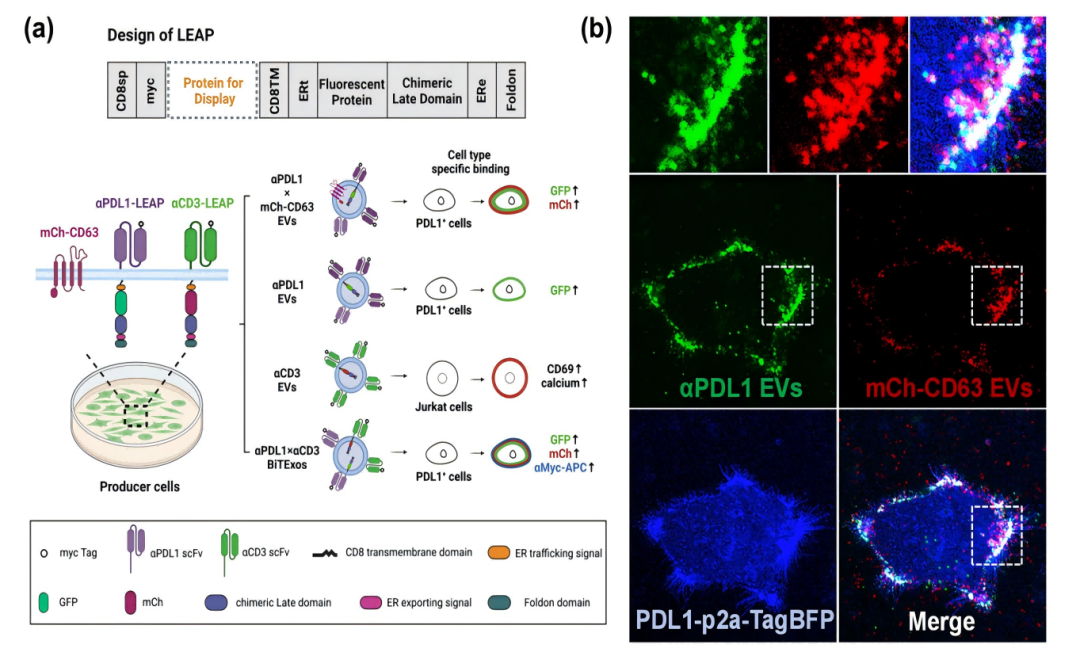
启发于病毒出芽及EVs生成释放的相似性,该研究构建了基于嵌合病毒晚期结构的合成支架蛋白LEAP。LEAP可通过ESCRT通路依赖的方式被高效分选至EVs中,LEAP支架蛋白可兼容多种单链抗体(scFv),将靶向肿瘤相关抗原(如PD-L1、EGFR、CD19)的scFv与LEAP支架蛋白相融合并表达至HEK293T细胞后,其衍生的EVs可靶向结合至表达相应抗原的靶细胞。


左右滑动查看更多
LEAP支架蛋白将PD-L1抗体和CD3抗体展示在EVs表面
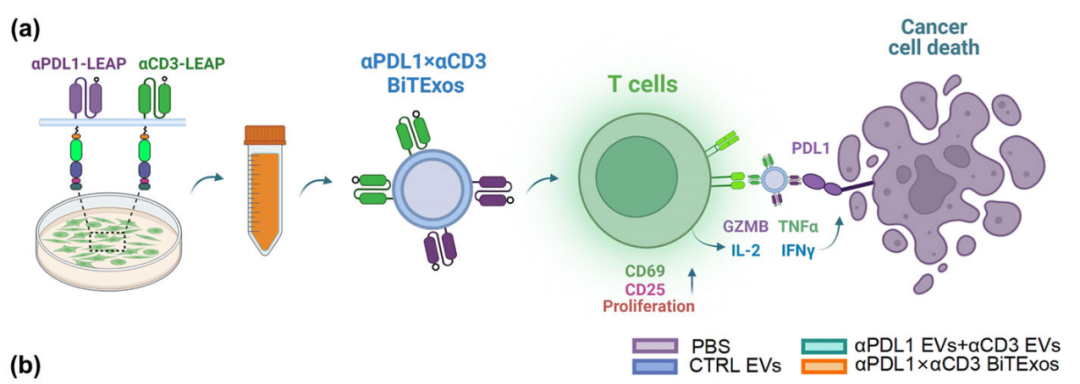
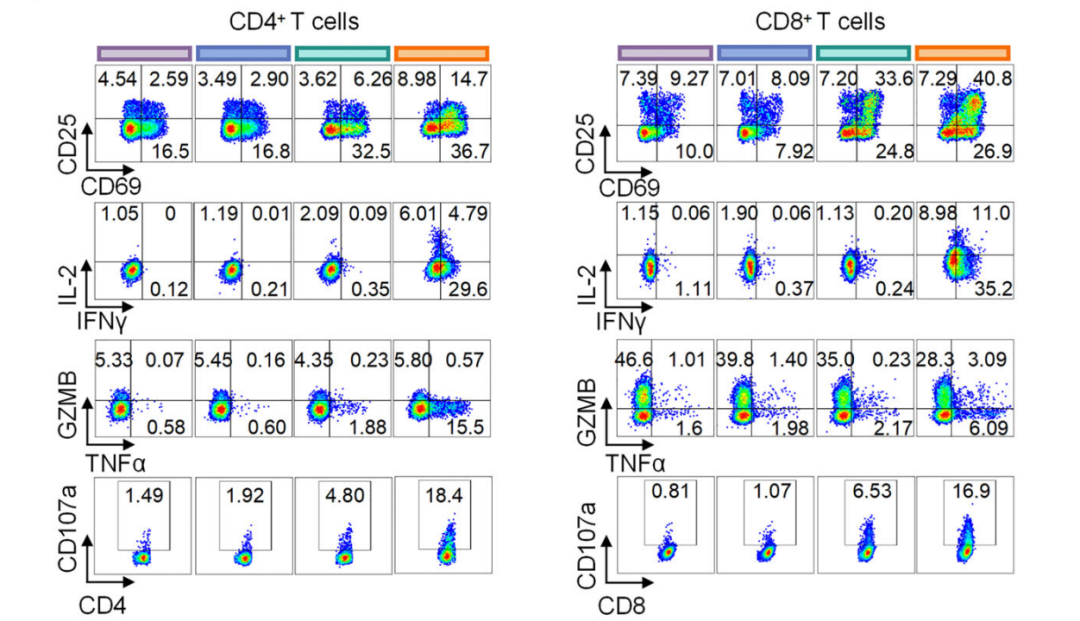
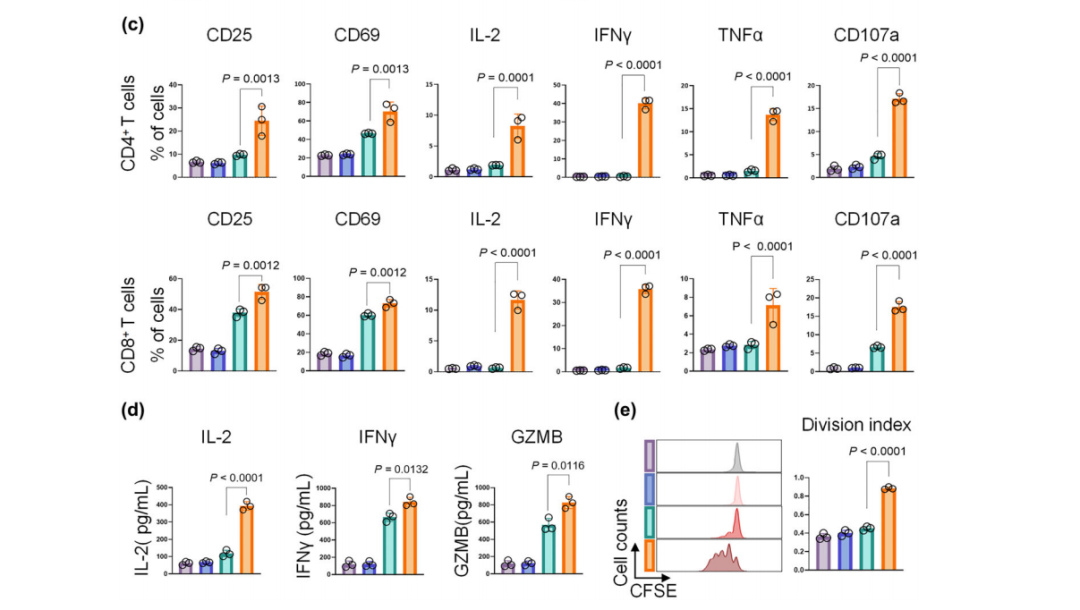
通过LEAP支架蛋白在EVs表面同时展示PD-L1抗体和CD3抗体,可将EVs重编程为双特异性T细胞衔接器,研究人员将其命名为双特异性T细胞衔接细胞外囊泡(αPD-L1×αCD3 BiTExos)。研究显示,αPD-L1×αCD3 BiTExos可通过αPD-L1臂结合PD-L1+肿瘤细胞,并通过CD3臂结合T细胞,从而将T细胞与PD-L1+肿瘤细胞衔接在一起,并通过CD3通路诱导T细胞活化、增殖和杀伤性因子的分泌,从而特异性地杀伤PD-L1+肿瘤细胞。在荷瘤小鼠模型中,αPD-L1×αCD3 BiTExos可促进T细胞在肿瘤微环境中的浸润,诱导杀伤性因子的分泌释放,有效激活T细胞抗肿瘤免疫。这项研究为工程化EVs在肿瘤免疫治疗中的应用提供了新的策略。同时,合成LEAP支架蛋白可作为EVs表面展示平台,有望应用于多种基于EVs的生物医学应用之中。
左右滑动查看更多
αPD-L1×αCD3 BiTExos有效激活T细胞抗肿瘤免疫
参考文献:
Chen R, Kang Z, Li W, Xu T, Wang Y, Jiang Q, Wang Y, Huang Z, Xu X, Huang Z. Extracellular vesicle surface display of αPD-L1 and αCD3 antibodies via engineered late domain-based scaffold to activate T-cell anti-tumor immunity. J Extracell Vesicles. 2024 Jul;13(7):e12490. doi: 10.1002/jev2.12490.

公司成立以来累计获得多轮数亿元融资,现已建成超 3000 平米的外泌体 GMP 生产车间,并与国内外上千家医院、科研院校及生物企业建立合作,合作发表论文200+篇,处理不同类型的样本4万+例,申报国内外发明专利30+件,获有“国家级专精特新小巨人企业”、“博士后科研工作站”、“国家高新技术企业”、“中关村金种子企业”、北京市知识产权试点单位”等荣誉。
公司致力于通过提供系统的外泌体研究与应用解决方案,赋能临床科研,加速产业转化,并通过持续的创新和严格的质量要求,让外泌体科技推动医学发展,造福美好生活!






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论