前言
门静脉癌栓(PVTT)是肝细胞癌(HCC)侵犯血管的主要形式。HCC患者合并PVTT的发病率为44.0%-62.2%,合并PVTT未行任何干预的患者中位生存期仅为2.7个月,明显低于未合并PVTT患者1。国际权威肝脏病学杂志Hepatology(IF:12.9)收录的一项多中心单臂II期研究结果显示,信迪利单抗+贝伐珠单抗联合放疗在HCC合并PVTT一线治疗中提供了良好的治疗反应和生存结局,客观缓解率(ORR)高达58.7%,中位无进展生存期(PFS)为13.8个月,中位总生存期(OS)达24.0个月,且安全可耐受2,该方案有望成为这部分患者的治疗新选择。

图1. Hepatology在线发表该研究数据
(图片来源于https://journals.lww.com/hep/abstract/9900/sintilimab_plus_bevacizumab_combined_with.745.aspx)
前景可期:靶免联合放疗治疗晚期HCC有迹可循
大多数HCC患者由于早期无明显症状,导致初诊时已处于晚期,预后不佳,尤其是合并PVTT的患者。全球III期IMbrave150研究和中国II/III期研究ORIENT-32均证实,PD-1/L1抑制剂联合抗血管内皮生长因子(VEGF)药物一线治疗不可切除的HCC患者,OS和PFS均优于索拉非尼3,4。基于这些研究结果,免疫检查点抑制剂(ICI)联合抗VEGF药物已成为初治晚期HCC(包括HCC合并PVTT)的新标准。但该方案的ORR和带来的长期生存仍然有限,还需继续探索新的治疗方案以供选择。
除了全身治疗,局部治疗对于控制肝内病变和提供更好的生存结局也至关重要。放疗(RT)是有效的HCC局部治疗方法之一,而且除了能控制肝脏原发肿瘤病灶外,RT在控制PVTT上也有一定作用。在作用机制上,RT有诱导机体主动免疫、提高免疫治疗疗效的潜力,同时,RT还能诱导HCC中VEGF的表达,因此,ICI与抗VEGF药物和RT联合治疗可潜在地协同治疗,更好地消除肿瘤。这一发现在动物模型和回顾性研究中已经得到证实5,6。
首次探索:信迪利单抗+贝伐珠单抗联合放疗绽放光彩
2024年2月15日,Hepatology发表了一项开放标签的前瞻性多中心、单臂II期研究,旨在评估PD-1抑制剂信迪利单抗联合贝伐珠单抗(抗VEGF药物)联合RT(Sin-Bev-RT)治疗HCC合并PVTT患者的有效性和安全性,并确定能预测生存的潜在生物标志物。研究纳入的46例患者在入组3天内接受第1周期信迪利单抗(200 mg)和贝伐珠单抗(15 mg/kg)治疗,在Sin-Bev治疗两个周期后1周内,开始RT治疗并输送至所有病灶。在锥束计算机断层扫描(CT)图像引导下,应用调强放射治疗,分10次输送处方剂量30-50 Gy。Sin-Bev在RT期间中断,RT后2周恢复,此后每3周持续一次,直到出现疾病进展、不可接受的毒性或撤回同意。主要终点为ORR,次要终点包括PFS、OS、疾病控制率(DCR)、局部控制率和安全性。
治疗情况
46例患者放疗前均接受2个周期Sin-Bev,放疗中位剂量为40 Gy(30-50 Gy)。共有37例患者停用Sin-Bev,36例因疾病进展,1例由不良事件(AE)导致。进展后,27例患者(58.7%)接受靶向治疗,7例患者(15.2%)接受经动脉化疗栓塞(TACE)/肝动脉灌注化疗(HAIC),1例患者(2.2%)接受全身化疗,1例患者(2.2%)接受支持治疗。
肿瘤缓解情况
ORR为58.7%(27/46),DCR为100%(46/46),中位缓解持续时间为6.2个月(IQR:0-15.4)。5例患者(10.9%)达到完全缓解(CR),22例患者(47.8%)达到部分缓解(PR),19例患者(41.3%)维持疾病稳定(SD)。46例患者的靶病灶均显示肿瘤消退。而且5例CR患者在数据截止时均未发生疾病进展,继续接受Sin-Bev治疗。
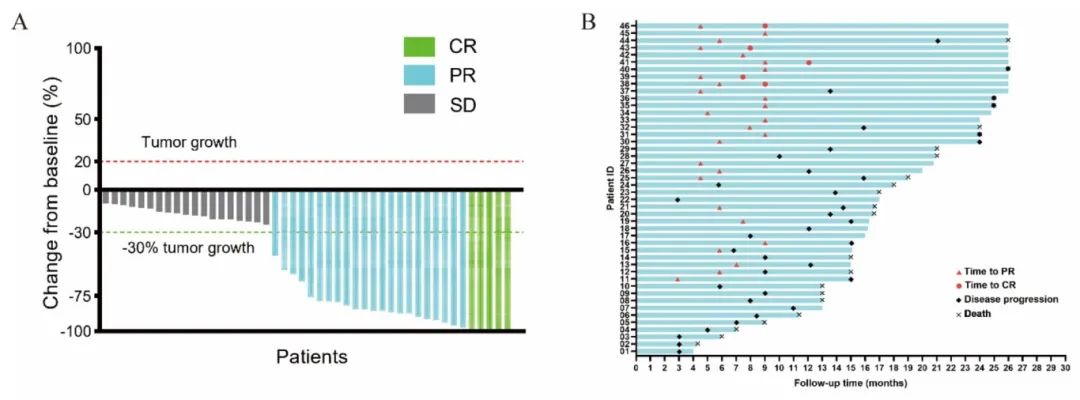
图2. 患者肿瘤缓解情况
PFS和OS数据
中位随访时间为26.0个月。患者的中位PFS为13.8个月(95%CI:12.0-21.0),而中位OS为24.0个月(95%CI:19.0-NA)。6个月、12个月和24个月局部控制率分别为89.1%、80.4%和80.4%。
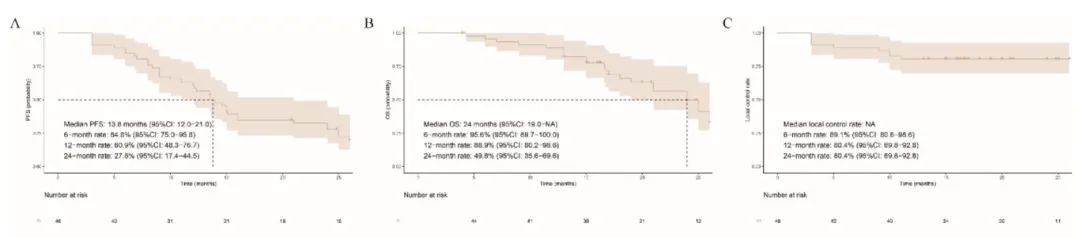
图3. PFS和OS的Kaplan-Meier曲线结果
(A:PFS;B:OS;C:HCC合并PVTT患者的局部控制)
基于程氏PVTT分型的亚组分析显示,I/II型PVTT患者的PFS和OS均显著长于III型PVTT患者(分别为P<0.001和P=0.009)。
安全性数据
未发生非预期AE或治疗相关死亡。最常见的任何级别AE是血液学毒性,包括白细胞计数降低(67.4%)和血小板计数降低(32.6%)。最常见的3-4级AE为血小板计数降低(8.7%)和高血压(8.7%)。
基因测序分析
根据基因改变进行的生存期单变量分析显示,仅PCMTD1与OS和PFS显著相关。进一步探索发现,PCMTD1突变患者的ORR为50.0%(3/6),略低于无PCMTD1突变患者(60.0%,24/40),但该差异不显著(P=0.680)。另外,PCMTD1突变患者的OS和PFS更短。
协同增效:增强IO疗效并延长暴露时间,改善患者获益
在目前的临床实践中,PD-1/PD-L1抑制剂联合抗VEGF药物已被广泛认可为晚期HCC的一线治疗方案,但这种联合治疗的ORR低于30%,仍有待进一步提高7。既往研究表明,肝内肿瘤大小决定了ICI治疗晚期HCC的疗效,并应用局部治疗方法减轻肝内肿瘤负荷可提高ICI疗效,从而改善患者预后。而且一些基础研究发现,RT可以增强肿瘤的“免疫原性”,改善肿瘤微环境,进而提高免疫治疗的疗效。部分回顾性研究已经显示,PD-1/PD-L1抑制剂联合抗VEGF药物再加用RT的ORR可达到40%以上8,9。但据了解,目前尚无前瞻性临床研究对此三联方案进行探索。
本项研究展开了首次前瞻性探索,研究人员假设,通过RT降低肝内肿瘤负荷和PVTT范围,患者肝功能和对Sin-Bev治疗的耐受性或将得到改善,可接受更多的Sin-Bev给药周期,并最终延长OS和PFS。可喜的是,Sin-Bev-RT治疗的ORR达到58.7%,进一步改善了HCC合并PVTT患者的生存获益。这也提示,在Sin-Bev联合治疗的基础上加用RT显示出了协同抗肿瘤作用,并产生了有利的肿瘤缓解。更重要的是,这种三联方案的肿瘤缓解也可以转变为长期生存获益,研究中患者的OS和PFS均较长,而且未观察到非预期AE和治疗相关死亡,表明安全性特征令人满意。
PVTT是临床上公认的影响HCC预后的重要因素之一,与无PVTT的患者相比,PVTT患者全身治疗的生存获益受损,这可能是由于PVTT控制不佳和肿瘤进一步浸润所致。另外,由于PVTT细胞对辐射具有较高的放射敏感性,RT已被证明在控制PVTT方面颇有成效。而且应用RT使血栓缩小也有助于门静脉血流的恢复,从而改善肝功能。另一方面,对PVTT的控制可有效地消除侵入局部血流的肿瘤细胞,减少进一步转移,最终产生了有希望的肿瘤反应和生存结果。因此,本研究对原发肿瘤病灶和PVTT均应用了RT治疗,相应地,Sin-Bev-RT治疗的24个月局部控制率达到80.4%,证实了该三联疗法具有较强的局部肿瘤控制能力。
除了探索该三联疗法的疗效和安全性,本研究还试图探索与抗肿瘤疗效改善相关的潜在基因组标志物。有趣的是,研究发现,PCMTD1突变与较低的缓解率、较短的OS和PFS相关。但PCMTD1在HCC中的作用需要进一步研究。总之,仍需要更大样本量和不同人群的研究来进一步确定Sin-Bev-RT联合治疗的预后生物标志物。
总的来说,这项前瞻性II期研究证明了信迪利单抗+贝伐珠单抗联合放疗方案作为初治的HCC合并PVTT患者的一线治疗具有良好的肿瘤反应和生存结局,以及良好的耐受性,是一种潜在的治疗选择,值得进一步开展全球、多中心的随机对照III期研究以验证本研究结果,最终惠及更多患者。
1.Zhang Z, Lai ECH, Zhang C, et al. The strategies for treating primary hepatocellular carcinoma with portal vein tumor thrombus. Int J Surg,2015,20:8-16.
2.Peng Z, Zhu M, Liu Z, et al. Sintilimab plus bevacizumab combined with radiotherapy as first-line treatment for hepatocellular carcinoma with portal vein tumor thrombus: A multicenter, single-arm, phase 2 study. Hepatology. 2024 Feb 15.
3.Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, Kudo M, et al. Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. N Engl J Med 2020;382:1894-1905.
4.Ren Z, Xu J, Bai Y, Xu A, Cang S, Du C, Li Q, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study. Lancet Oncol 2021;22:977-990.
7.Rao Q, Li M, Xu W, et al. Clinical benefits of PD-1/PDL1 inhibitors in advanced hepatocellular carcinoma: a systematic review and meta-analysis. Hepatol Int 2020;14:765-775.
8.Heimbach JK, Kulik LM, Finn RS, et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology 2018;67:358-380.
9.Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis 2010;30:52-60.
本文旨在为医疗卫生专业人士传递更多医学信息,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,信达不推荐任何未获批的药品/适应症使用。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论