
导读
2024年8月2日,普沐生物科技有限公司(以下简称“普沐生物”)与公司创始人汤楠博士领导的北京生命科学研究所/清华大学生物医学交叉研究院科研团队及中日友好医院的代华平教授团队,在国际权威期刊Cell Stem Cell上在线发表了题为"Sustained amphiregulin expression in intermediate alveolar stem cells drives progressive fibrosis"的研究论文。该研究系统性地阐述了公司开发用于治疗特发性肺纤维化(Idiopathic Pulmonary Fibrosis,IPF)的全球首创(first-in-class)新药PMG1015所针对的靶点Amphiregulin(AREG)在纤维化疾病中靶点发现、功能验证和作用机制方面的临床前研究成果,并且通过在IPF病人上的转化医学研究明确了AREG与IPF发生发展的密切关系。本研究的相关发现不仅揭示了IPF发病的新机制,发现了新靶点,也证实了靶点拮抗剂在临床前模型中的药效,为公司新药PMG1015的研发提供了坚实的理论基础,为IPF疾病的治疗带来了新希望。

Pulmongene
IPF治疗现状与挑战
Pulmongene
突破性发现:
肺泡干细胞持续分泌的AREG是促进肺纤维化的关键因素
最后,研究人员针对AREG进行药物干预来延缓或阻止肺纤维化进展,开展了探索性研究。研究结果表明,通过使用中和抗体有效地阻断AREG,可以显著抑制小鼠肺纤维化的发生和发展,并显著提升动物的生存率。这一发现不仅突显了抗AREG抗体在减缓IPF进展方面的治疗潜力,还提供了一种有前景的纤维化疾病治疗新策略。
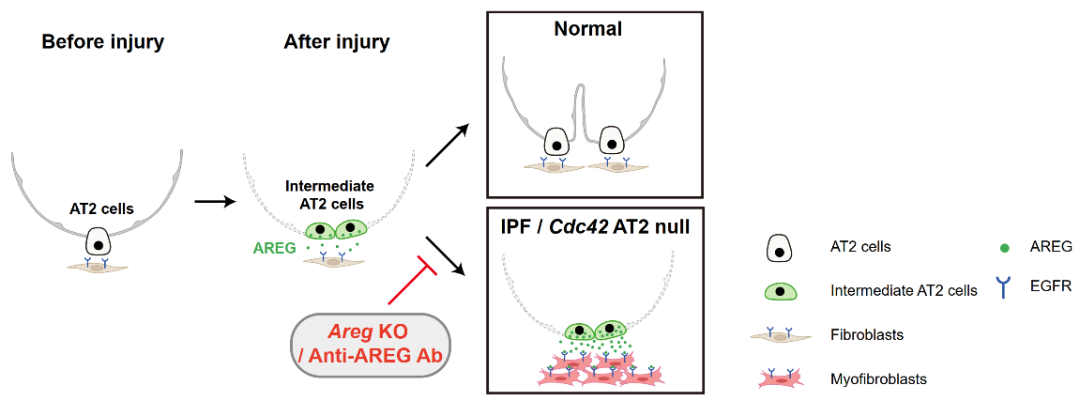
Figure 1:中间态肺泡干细胞促纤维化发生的作用机制示意图
综上,本研究基于进展性肺纤维化动物模型和临床转化医学研究,系统性地揭示了中间态肺泡干细胞及其表达的AREG在肺纤维化发生和发展中的关键作用,并发现了其表达水平与IPF疾病严重程度成正相关 (Figure 1)。这项突破性发现不仅揭示了中间态的肺泡干细胞参与进行性肺纤维化的细胞和分子机制,加深了对IPF病理机制的理解,还为开发新的治疗方法提供了重要线索,提出了靶向肺泡干细胞中的AREG治疗IPF的新策略。此外,这一研究还为其他类型的纤维化疾病的研究提供了参考,靶向AREG可能在其他纤维化疾病中也具有潜在疗效。总之,本研究不仅对理解和治疗IPF具有重要意义,还为更广泛的纤维化疾病研究和治疗提供了新思路。
Pulmongene
新药PMG1015
精准靶向,IPF治疗新希望
基于上述发现,普沐生物开发出了全球首创靶向AREG的单克隆抗体PMG1015。该药物旨在通过阻断AREG介导的EGFR信号传导,从而减缓或阻止IPF的进展。PMG1015于2023年被美国食品药品监督管理局授予“孤儿药资格认定”,并在澳洲和中国均已完成Ia期临床试验。在已完成的Ia期临床试验中,PMG1015均显示出了优秀的药物安全性和耐受性。目前PMG1015正在开展针对IPF患者的1b期临床研究。
普沐生物创始人汤楠博士表示:“本项关于靶点的研究是在普沐生物科技有限公司科研团队和国内多个医学团队、科学研究团队的紧密合作下顺利完成的,这也充分体现了基础科学研究、医学以及工业界转化医学的合作对于疾病机理研究和新药研发的重大推动作用。公司将持续加速推进PMG1015管线的临床开发进程,力争早日将该药物推向市场,为全球IPF患者带来福音。同时,公司也将继续深化与国内外顶尖科研机构的合作,不断探索新的治疗靶点和治疗方法,为呼吸系统疾病和纤维化疾病的治疗贡献更多力量。”

查看论文请点击文末“阅读原文” 或 复制下方链接

文章链接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(24)00254-6
Pulmongene
Reference
上下滑动查看更多

























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论