
2024年5月31日,Moderna宣布旗下用于保护60岁及以上成年人免受RSV感染所引起的下呼吸道疾病的mRNA疫苗mRESVIA获FDA批准上市,这是继Covid-19 mRNA疫苗后第二款上市的mRNA疫苗。mRESVIA的上市基于其三期临床的积极数据,也再次证明了mRNA药物的可商业性。
mRNA药物具有开发周期短、生产速度快的优势,其开发过程可以概括为质粒DNA的制备、线性化DNA模板的制备和纯化、体外转录(In Vitro Transcription, IVT)、mRNA纯化和脂质纳米颗粒(Lipid Nano Particle, LNP)包封,而分析方法开发和质量控制伴随mRNA药物的整个生命周期。

图1 mRNA工艺流程和分析[1]
2023年4月,USP针对mRNA疫苗发布了第二版《Analytical Procedures for mRNA Vaccine Quality-Draft guidelines: 2nd Edition》,基于质量源于设计(QbD)的概念,将表征和放行测试分为三个主要阶段:质粒DNA模板、mRNA原液和mRNA-LNP成品。以下将针对这三个阶段的表征和放行测试展开进行阐释。

质粒DNA一般具有三种基本形态,包括超螺旋(Supercoiled, SC)、开环(Open Circular, OC)、线性化(Linear, L),而每种形态又有多种聚合形式。其中,超螺旋形态被认为是高质量的起始材料,在基因质粒和DNA疫苗的研究中也对药用质粒的超螺旋含量做了明确要求(FDA要求>80%,NMPA要求≥90%,SMPA要求>85%)。
目前,常见的质粒超螺旋检测方法有琼脂糖凝胶电泳(Agarose Gel Electrophoresis, AGE)、毛细管凝胶电泳(Capillary Gel Electrophoresis, CGE)和阴离子交换-高效液相色谱(Anion-Exchange-HPLC,AEX-HPLC)。AGE具有成本低、通量大、速度快的优点,通常会用在工艺过程检测中,但其局限在于开环质粒和超螺旋二聚体通常无法分离,因此需要在需要进行准确定量时CGE或HPLC是更好的选择(图2)。
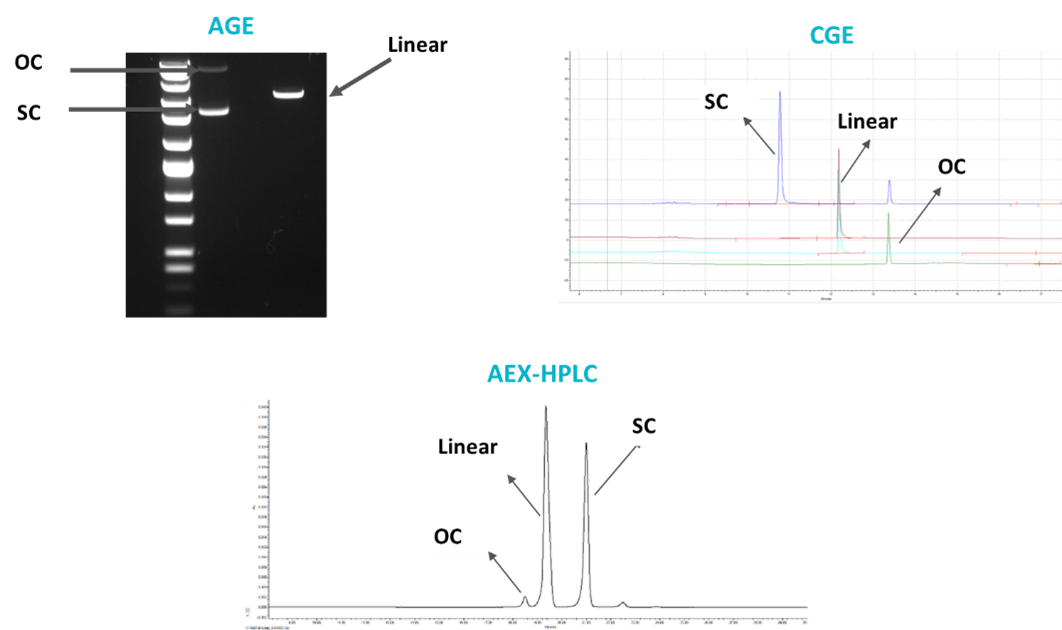
图2 质粒超螺旋纯度检测方法图例
除超螺旋纯度外,质粒的放行质控项目还包括:外观、pH、鉴别、浓度/纯度、HCD等残留检测及安全性检测。
表1 质粒放行质控项目

























 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论