全文4200字,预计阅读需要25分钟


Enasidenib(AG-221)
由Agios Pharmaceuticals与Celgene(现隶属于百时美施贵宝公司)携手研发的Enasidenib(AG-221,商品名Idhifa),于2017年8月1日获得了美国食品药品监督管理局(FDA)的批准,这一里程碑式的成就标志着全球首款针对IDH突变体的口服选择性抑制剂正式问世。这款药物显示出如下重要特性与优势:
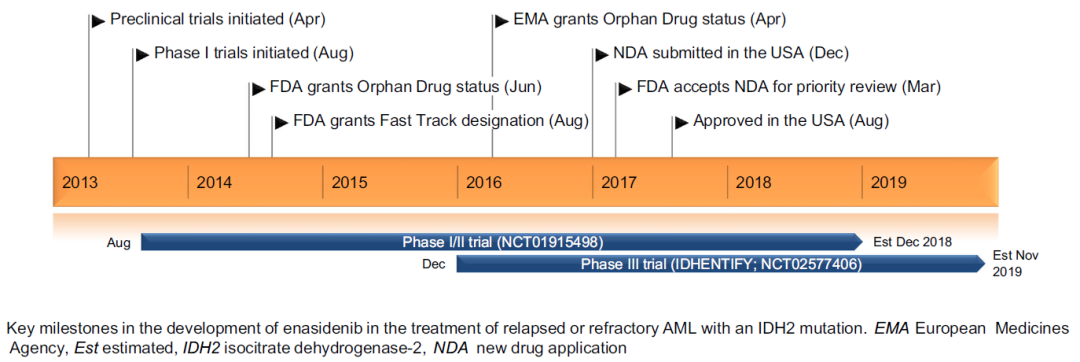
图1. Enasidenib(AG-221)研发的关键里程碑[1]
同类首创的里程碑

临床上亟需,2017年之前40年来AML这个疾病领域一直没有新药获批,眼看着其他肿瘤领域靶向疗法、免疫疗法纷纷取得突破,提示重大的源头创新才可能取得突破赋能。作为同类首创(First-in-class)药物,Enasidenib开创了IDH突变体靶向治疗的新纪元。它精准地针对IDH2基因突变,这一在AML中频繁出现的遗传异常,通过抑制突变型IDH2酶的活性,阻断了异常代谢途径,为AML的治疗开辟了一条全新的路径。其获批用于一线治疗复发/难治性IDH2突变AML,并带来了后续一系列IDH靶向药物的开发获批,是AML治疗迈出的一大步,是真正意义的创新机理(MoA)的First-in-Class,超越了单个target的First-in-Class,是具有革命性的意义的突破,是对传统治疗手段的强有力的超越和补充。
诱导分化的新机制

Enasidenib的独特之处在于其诱导肿瘤细胞分化的机制,这与传统的细胞毒作用截然不同。它通过恢复白血病原始细胞(blast cell)正常分化过程,促使白血病原始细胞逐渐向功能健全的成熟细胞转化,从而减少了恶性细胞的增殖和累积。这种机制不仅减少了治疗过程中的毒副作用,还提高了治疗的特异性和有效性,同时恢复血液细胞的分化和功能,后者可能从概念验证角度展示了表观遗传学机制的成药特性以及优势,也用药物作为工具验证了AML的发病机理。虽然诱导分化疗法早已通过三氧化二砷、反式维甲酸等药物在APL取得重大突破,但这些疗法是先有了效果再寻找机制,而IDH2疗法是从机理出发转化为临床成功,展示了现代转化医学的巨大进步,这种成功是极为少见的,因而具有重大的科学和临床价值。
表观遗传调控的深远影响

Enasidenib的治疗效应不仅仅局限于直接的靶点抑制,还深刻影响了细胞的表观遗传状态。这意味着该药物能够调控基因表达模式,影响细胞的生长、分化和凋亡等关键生物学过程。然而,这一复杂的调控过程需要时间来逐步显现,因此Enasidenib的治疗通常需要持续多个周期(至少6个月),以充分发挥其疗效。
安全性和耐受性良好

在临床试验中,Enasidenib展现出了良好的安全性和耐受性,为患者提供了更为舒适的治疗体验。与传统化疗相比,其副作用相对可控,且多数为轻至中度,使得患者能够更好地配合治疗计划,提高治疗的依从性。
联合治疗的广阔前景

鉴于Enasidenib的独特作用机制和良好的安全性,它非常适合用作联合治疗方案。通过与其他药物或治疗手段的协同作用,有望进一步提升对复发/难治性AML的治疗效果,延长患者的生存期。
临床前研究
Enasidenib(AG-221)的临床前研究极为扎实,为后续的临床试验奠定了坚实的基础。苗头化合物来自针对IDH2R140Q突变体的高通量筛选实验,进一步通过化学优化得到最后的临床分子AG-221(图2)。AG-221展现出出色的2-HG抑制、良好的溶解性、低清除率和不错的口服利用度。和IDH2R140Q的共晶揭示AG-221结合在IDH2R140Q二聚体界面的变构位点上。这个结合一下子击中了IDH突变蛋白的“七寸”,锁死了蛋白开放的二聚体构象,阻止了催化反应必须的构象变化。


图2. AG-221结合在IDH2R140Q二聚体界面的变构位点上,
阻止催化反应必须的IDH蛋白构象变化[2]
AG-221是典型的slow-on/slow-off抑制剂,这种抑制剂类型在与靶标酶结合后,形成稳定的复合物,解离速度相对缓慢,从而确保了持续且有效的抑制作用。进一步地,AG-221对底物α-KG表现出非竞争抑制模式(noncompetitive inhibition),对辅因子NADPH表现出反竞争抑制模式 (uncompetitive inhibition)(图3)。这种具有非/反竞争抑制作用机制的小分子抑制剂具有很多先天优势:(1)α-KG/2-HG和NADPH在细胞中的浓度可能很高,远远超过IDH突变蛋白对它们的亲和力。非/反竞争抑制机制使得AG-221能够避免与底物/辅因子直接竞争,更高效占据酶活抑制位点,将2-HG抑制到背景水平。(2)与直接结合在酶活性口袋、与底物/辅因子形成竞争性抑制的抑制剂相比,AG-221的非/反竞争抑制机制显然具有更高的效率和更广的适用性。竞争性抑制剂需要直接与底物/辅因子竞争结合位点,这在底物/辅因子浓度较高时尤为困难。而AG-221则巧妙地避开了这一难题,通过其独特的抑制机制,“四两拨千斤”,实现了对IDH2突变体的高效、持久抑制。
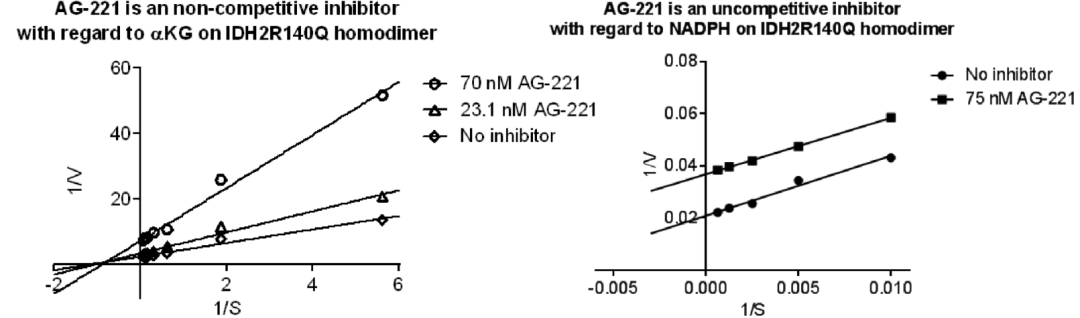
图3. AG-221的抑制机制[2]
AG-221对IDH不同突变体的抑制活性如表1所示。AG-221表现出对IDH2的两个热点突变R140Q和R172K的同源二聚体有很好的抑制,对WT/R140Q和WT/R172K两个异源二聚体的抑制效果更为亮眼。前文我们说到IDH突变都是杂合突变,细胞内表现为大量的IDH突变蛋白为一份野生型蛋白和一份突变蛋白组成的异源二聚体,像接力队员一样,由野生型IDH蛋白催化异柠檬酸变为α-KG,而突变型IDH蛋白则进一步接力催化α-KG变为2-HG。AG-221则可以完全抑制IDH异源二聚体的催化功能,不仅抑制野生型IDH蛋白催化异柠檬酸变为α-KG (oxidative),还抑制突变型IDH蛋白催化α-KG变为2-HG (reductive)。此外,AG-221的slow-on/slow-off抑制特性在其对不同抚育时间下IC50值的变化中得到了充分体现。这种特性使得AG-221与靶标酶的结合更加稳定且持久。值得注意的是,AG-221对IDH2WT同源二聚体的抑制较弱,因此AG-221对正常细胞几乎没有影响,这在一定程度上保障了AG-221在临床应用中的安全性。
表1. AG-221对IDH不同突变体的酶活抑制活性[2]

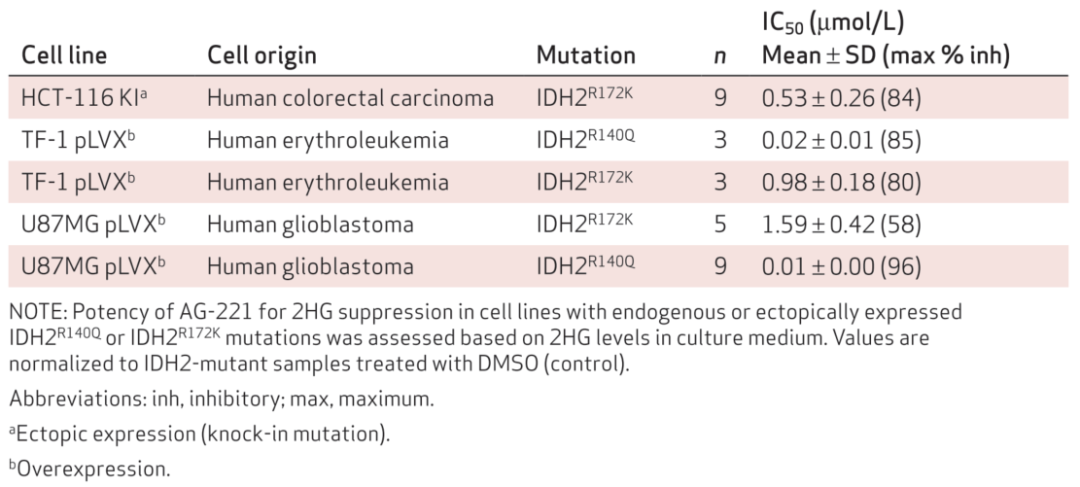
临床前研究还构建了表达各类特定IDH2突变体的细胞模型。经AG-221处理后能显著降低细胞产生的2-HG在培养基中的累积,IC50如表2所示(胞内2-HG水平的变化可能更相关,文章比较了胞内和培养基中2-HG的变化趋势,发现两者相关性非常好,就用更易测的培养基中2-HG代替)。虽然AG-221对IDH2R140Q和IDH2R172K突变的酶活抑制IC50很接近,但细胞实验结果显示AG-221在细胞内对IDH2R140Q突变体显然抑制效果更好。
表2. AG-221对携带IDH2突变的细胞内2-HG的抑制活性[2]
AG-221对于携带IDH2R140Q和IDH2R172K突变的AML病人原代细胞的2-HG水平也有明显抑制(图4)。与细胞系实验结果一致,携带IDH2R140Q突变的AML病人原代细胞比携带IDH2R172K突变的细胞对AG-221的抑制作用更敏感。
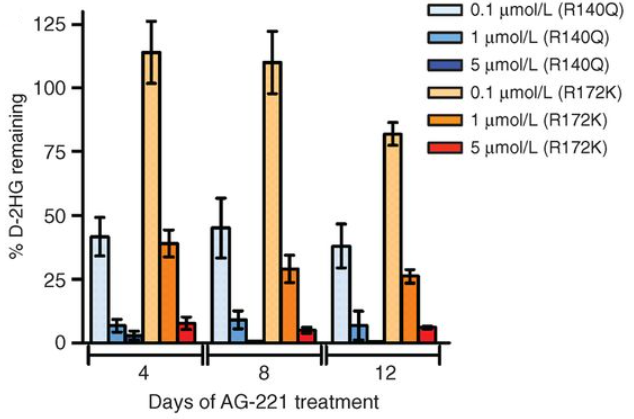
图4. AG-221显著抑制携带IDH2
突变的AML病人原代细胞的2-HG水平 [2]
在深入探讨IDH突变与肿瘤生物学特性的关系时,一个核心发现是IDH突变引发的2-HG累积能够竞争性抑制一系列关键的α-KG依赖的双加氧酶,这些酶在细胞表观遗传调控中扮演着至关重要的角色。具体而言,受影响的酶包括调控组蛋白甲基化状态的组蛋白去甲基酶和TET家族甲基胞嘧啶双加氧酶,它们的功能受阻直接导致了细胞表观遗传的失调。这种失调不仅破坏了正常的基因表达模式,还与多种细胞类型(尤其是造血细胞)的分化障碍紧密相关,进而促进了肿瘤的发生与发展。[3,4]
在这样的背景下,AG-221作为一种针对IDH2突变的特异性抑制剂,其治疗潜力显得尤为引人注目,它揭示了这一抑制作用的深远影响——促进细胞分化而非简单地诱导细胞凋亡。经AG-221处理后,IDH2突变的细胞不仅2-HG水平下降,而且与粒细胞分化相关的细胞表面标志物表达显著增加。这一变化不仅在分子水平上得到了验证,还通过细胞形态学检测得到了直观的支持,证明AG-221可直接诱导AML原始细胞分化(图5)。换句话说,对AG-221系列化合物的优化过程,并不依靠传统的细胞毒作用或杀伤机制评估的assay和IC50等指标进行SAR判定(例如:受体酪氨酸激酶靶点)。推测这点可能也是其临床上安全性出色的原因之一,因为对非骨髓/血液系统的正常细胞诱导分化并不容易,只要不直接杀伤细胞,安全性就有保障。事实上临床看到主要的安全风险也是诱导分化综合征之类的on-target tox,类似传统的小分子抗肿瘤药的细胞毒作用非常轻微。
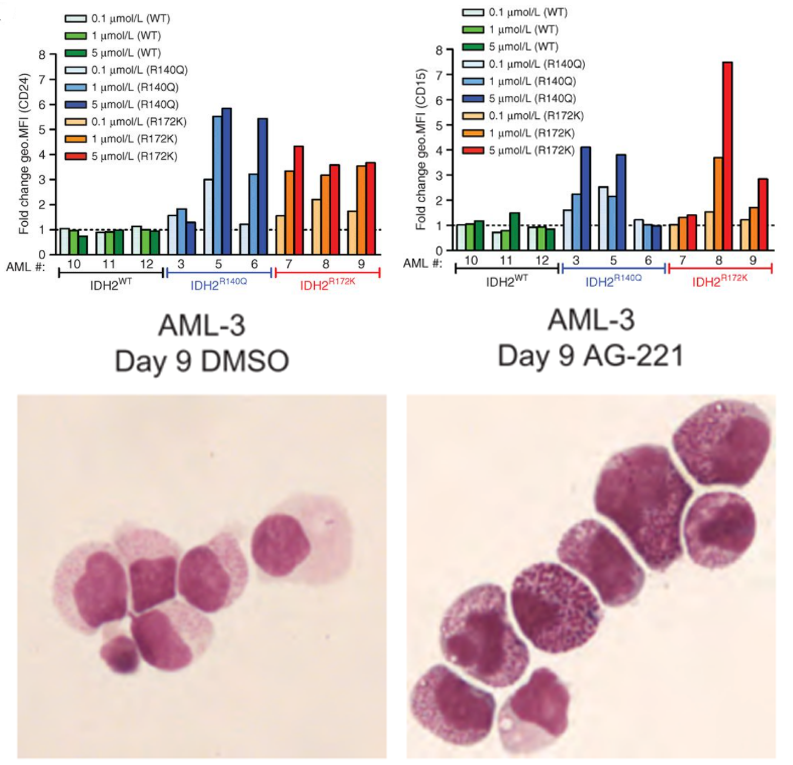
图5. AG-221上调髓系分化相关标志物CD24和CD15,
并诱导AML-3细胞分化成熟[2]
在基于AML病人原代细胞建立的小鼠PDX模型上,AG-221也显示出促分化的药效,这一效果不仅与生存获益相关,还呈现出剂量依赖的特性(图6A)。进一步分析显示,第84天时,小鼠骨髓中原始细胞(Blasts)百分比呈现出明显的剂量依赖性下降(图6B),这一结果直接反映了AG-221在促进AML细胞分化方面的强大能力。细胞形态学检测也印证了这个结果。结果显示在接受45mg/kg AG-221给药的小鼠骨髓中,细胞形态发生显著变化,呈现出更成熟的分化髓系细胞形态,具有细胞核侧向化、染色质粗大和嗜酸性细胞质的特性(图6C)。
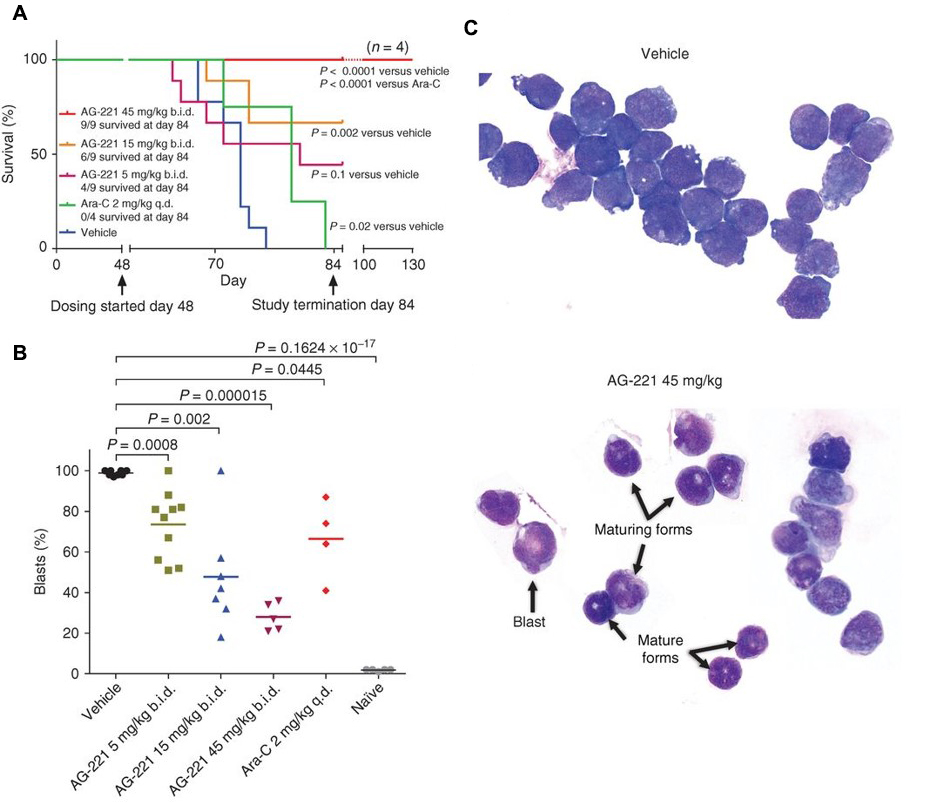
图6. AG-221对AML荷瘤小鼠存活率
及AML blast细胞分化的影响[2]
在深入剖析AG-221的临床前数据后,我们可以得出以下几个要点:
1
高度特异性的IDH2突变抑制剂
AG-221作为一种靶向IDH2突变的小分子抑制剂,展现出了对IDH2突变体的高度选择性抑制作用。它能够有效地阻断IDH2突变酶的催化活性,从而显著减少异常代谢产物2-HG的生成。与此同时,AG-221对野生型IDH2的抑制作用相对较弱,这一特性确保了其在临床治疗过程中的安全性和特异性,减少了潜在的脱靶效应。
2
促进细胞分化而非凋亡
与传统化疗药物不同,AG-221并不直接诱导AML细胞凋亡,而是通过抑制IDH2突变,解除2-HG对α-KG依赖双加氧酶的抑制作用,进而恢复血液细胞的正常分化潜能。这一机制使得AG-221在治疗过程中能够促使AML原始细胞向更成熟的细胞类型分化,而非简单地杀灭肿瘤细胞。
3
表观遗传调控与长期疗效
AG-221的药理作用机制涉及复杂的表观遗传调控网络。通过降低2-HG水平,AG-221能够恢复正常的组蛋白和DNA甲基化状态,进而调控基因表达,促进细胞分化。这一过程需要相对较长的时间来逐步重建细胞内的表观遗传平衡。因此,AG-221的临床疗效往往不是立竿见影的,而是随着治疗时间的延长而逐渐显现。

参考文献:
1.Kim ES. Enasidenib: First Global Approval. Drugs. 2017;77(15):1705-1711.
2.Yen K, Travins J, Wang F, et al. AG-221, a First-in-Class Therapy Targeting Acute Myeloid Leukemia Harboring Oncogenic IDH2 Mutations. Cancer Discov. 2017;7(5):478-493.
3.Figueroa ME, Abdel-Wahab O, Lu C, et al. Leukemic IDH1 and IDH2 mutations result in a hypermethylation phenotype, disrupt TET2 function, and impair hematopoietic differentiation. Cancer Cell. 2010;18(6):553-567.
4.Lu C, Ward PS, Kapoor GS, et al. IDH mutation impairs histone demethylation and results in a block to cell differentiation. Nature. 2012;483(7390):474-478.
撰稿:
编辑:
排版:
Keller
隐 杉
默 尧



扫码关注赛岚医药





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论