
发表在《Nature》子刊上的文章题为《利用分子动力学优化BGM0504,增强双靶点激动作用,以对抗糖尿病和肥胖症(Molecular dynamics-guided optimization of BGM0504 enhances dual target agonism for combating diabetes and obesity)》。本文由博瑞医药董事长袁建栋博士和予路乾行计算部负责人刘文朗为共同第一作者、博瑞医药和武汉理工大学作为共同通讯单位。这一发现得到了多家海外知名媒体如美通社、美联社、朝日新闻等机构的关注和报道。
BGM0504是采用分子动力学模拟技术(Molecular Dynamics, MD)辅助设计的GLP-1和GIP双受体激动剂,在体外和体内实验中均显示出卓越的疗效。
研究团队利用分子动力学模拟技术,发现了GLP-1R和GIPR上的特定氨基酸残基与备选多肽激动剂相应位置的氨基酸侧链之间可能出现稳定的盐桥作用。该盐桥作用不仅可以进一步稳定备选多肽激动剂与双受体的结合稳定性,更有利于稳定双受体的激活态构象。而这种相互作用并未被先前的晶体学研究或冷冻电镜研究所确认发现。
随后,BGM0504的设计将酰化位点移至第40位氨基酸位点。通过这种设计,将多肽分子对GLP-1R和GIPR的激动作用相较于替尔泊肽提升到三倍,同时保持了良好的药物体内半衰期,在糖尿病和肥胖症小鼠模型中均取得了卓越的治疗效果。
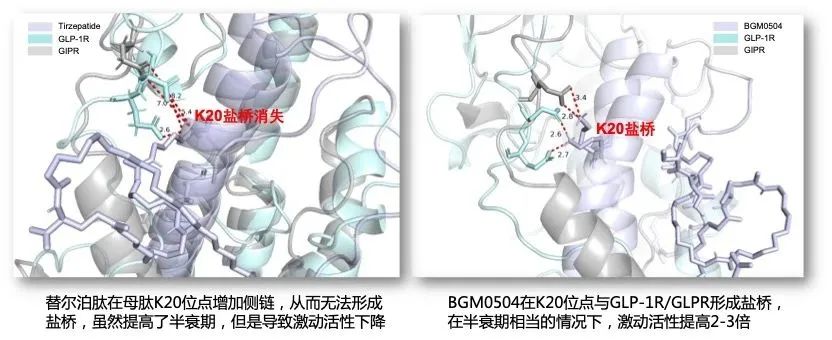
图1. K20盐桥:BGM0504比替尔泊肽强2-3倍激动活性的关键

图2. BGM0504理性设计后的结构对比(来自Nature子刊文章)
在体内外实验的研究中,BGM0504相比Tirzepatide在GLP-1R/GIPR上提升到3倍的激动活性,这解释了BGM0504在小鼠体内的研究中能够具有更加好的降糖和减重的效果的原因。此外,BGM0504相比Tirzepatide与人血清白蛋白具有更强的结合能力。在关键的大鼠和食蟹猴的药代动力学研究中,实验动物在BGM0504不同的剂量下表现出很好的耐受性,且BGM0504的半衰期能够达到一周注射一次的效果,同时具有持续较高的血药暴露量来维持药效的发挥。这些研究表明,BGM0504作为一种用于治疗糖尿病和肥胖症的多肽药物具有良好的安全性和有效性。
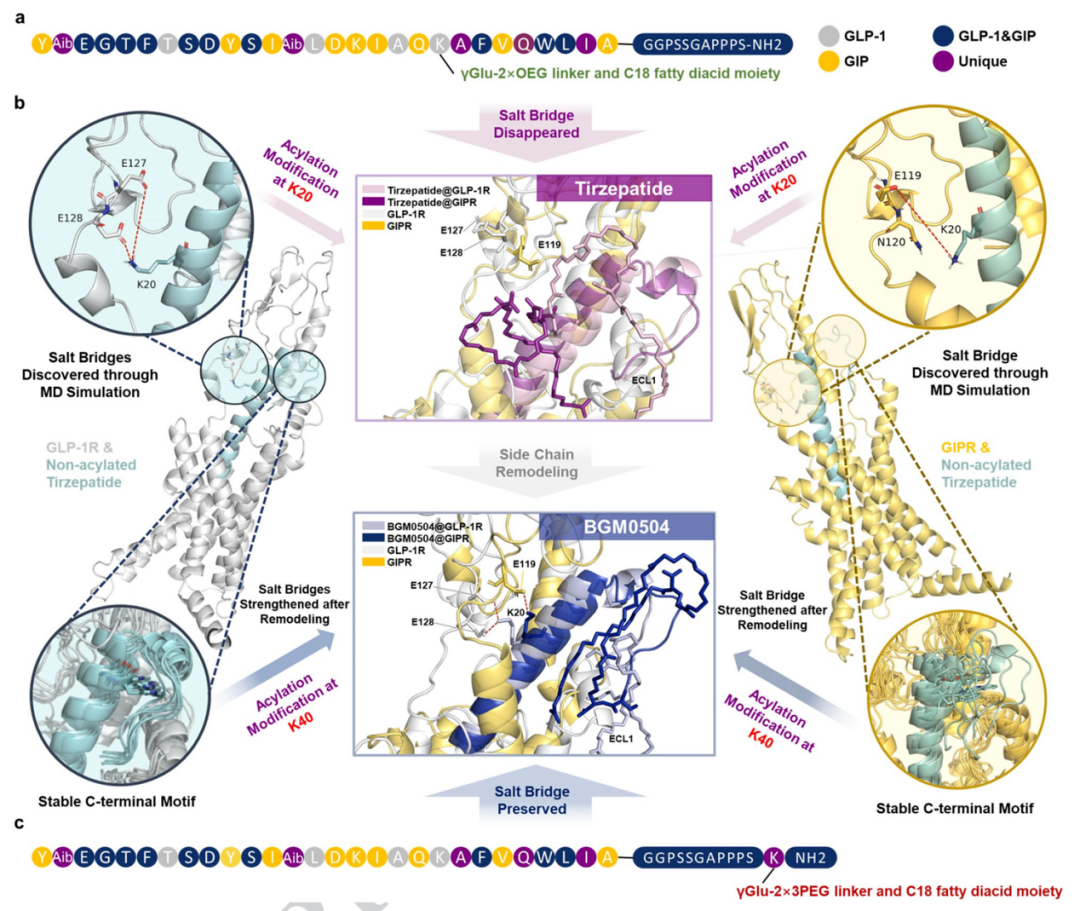
图3. 替尔泊肽和BGM0504的结构分析对比和优化策略(来自Nature子刊文章)
在此基础上,予路乾行正在与博瑞医药开展全方位合作,利用分子动力学模拟平台结合AI技术,助力多条新药研发管线的快速推进。
博瑞医药(股票代码:688166.SH)是一家专注于开发高端药品的创新型制药公司。公司整合了原料药和制剂,结合仿制药和创新药,以满足全球临床需求。BGM0504 注射液是博瑞医药(688166.SH)自主研发的 GLP-1和 GIP受体双重激动剂,可激动GIP和 GLP-1下游通路,产生控制血糖、减重和治疗非酒精性脂肪性肝炎(NASH)等生物学效应,展现多种代谢疾病治疗潜力。
予路乾行是一家以人工智能、量子力学及分子模拟算法为核心技术,通过模拟运算赋能新药研发的交叉学科技术驱动型生物医药公司。公司结合多尺度分子动力学模拟技术和AI算法,通过打造独创的“分子电影”数据及算法平台,揭示复杂生物体系的动态分子机制,填补了针对难成药靶点药物研发领域的空白。公司提供各类计算化学服务,合作方式灵活,可在PCC之前的各个阶段提供帮助。适用的模式包括小分子、PROTAC、ADC、抗体、多肽、融合肽、XDC等。
参考资料
[1] Yuan, J., Liu, W., Jiang, X. et al. Molecular dynamics-guided optimization of BGM0504 enhances dual-target agonism for combating diabetes and obesity. Sci Rep 14, 16680 (2024). https://doi.org/10.1038/s41598-024-66998-8
[2] https://www.prnewswire.com/news-releases/nature-study-reveals-ai-and-molecular-dynamics-designed-bgm0504-exhibits-superior-potency-302202619.html
[3] https://apnews.com/press-release/pr-newswire/clinical-trials-medication-artificial-intelligence-e9f0ac1f75948e0bb0acf98a3b62cdea
[4] https://www.asahi.com/and/pressrelease/424914237/





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论