
免疫球蛋白(Ig)以B细胞受体(BCR)的形式存在于B细胞表面,或在分泌时以抗体的形式存在,在识别和应对抗原威胁中起着关键作用。共同表征BCR和抗体库对于了解人类适应性免疫至关重要。
BCR测序(BCR-seq)是研究Ig组库基因多样性的重要途经,但它不能用于表征分泌型抗体。而通过质谱技术进行的抗体肽测序(Ab-seq)提供了血清中分泌抗体组成的信息,能够在蛋白质组学水平上确定抗体序列。BCR-seq与Ab-seq的整合有望连接适应性免疫库的基因组和蛋白质组学水平。
如何整合抗体库的基因组和蛋白质组信息?今天我们分享三篇文章对此进行了优秀示范。


标题:人类B细胞受体基因组和抗体蛋白质组分析的基准和整合
发表期刊:Npj Systems Biology and Applications
发表时间:2024年7月
作者通过健康人PBMC的bulkBCR-seq和单细胞BCR-seq(scBCR-seq),以及血清Ab-seq,并结合公开测序数据,进行了三种技术生成的数据集的重叠和互补程度的基准测试。该研究为结合bulk测序、单细胞测序和质谱作为完整捕获体液免疫的互补方法奠定了理论基础。

作者共使用了三个数据集。数据集1包含1例健康人的bulkBCR-seq、scBCR-seq和Ab-seq数据,采用液相色谱与串联质谱(LC-MS/MS)进行肽分析。数据集2包含10例健康成人的bulkBCR-seq、scBCR-seq数据。数据集3是来自6名儿科患者的公开BCR-seq数据,分选了不同的B细胞亚群进行的bulk和scBCR-seq。

图1
作者进行了同一个体和不同个体每种测序方法的结果比较,发现尽管方法之间存在差异,但bulkBCR-seq和scBCR-seq都足以表征个体独特的VH基因使用概况,与技术方法、细胞亚群这些因素相比,个体是VH基因使用的最大决定因素,也就是说同一个体的V基因使用情况相似程度最高。
通过不同测序方法的共享CDR3序列分析比较,发现bulkBCR-seq提供的更高采样深度可以更好地覆盖BCR库多样性,特别是在本身高度多样化的B细胞亚群中,例如幼稚B细胞。对于scBCR-seq,合并技术重复有助于弥补BCR库的低覆盖率和与bulkBCR-seq的低克隆序列重叠比例。
接下来作者研究了Ab-seq是否可用于鉴定血清抗体中的特定克隆型,并有可能从短肽中回收完整的V(D)J序列。当Ab-seq肽唯一地映射到该克隆型BCR-seq 参考序列并与其CDR3序列连续重叠至少3aa时,即可识别出克隆型。有887(4.8%)个肽满足该条件,与scBCR-seq相比,bulkBCR-seq贡献了大部分肽匹配。按抗体酶对CDR3重叠肽进行分组,胰蛋白酶提供的重叠肽最多,其次是AspN。在887个CDR3重叠的肽中,34.8%的肽定位于唯一的参照克隆型,65.2%定位于多个参照克隆型。研究BCR参考克隆型的排序分布,即克隆丰度,作者发现几乎所有独特定位的CDR3重叠肽与扩增较少的克隆型对齐,bulkBCR-seq与scBCR-seq均观察到类似的趋势。(图2)
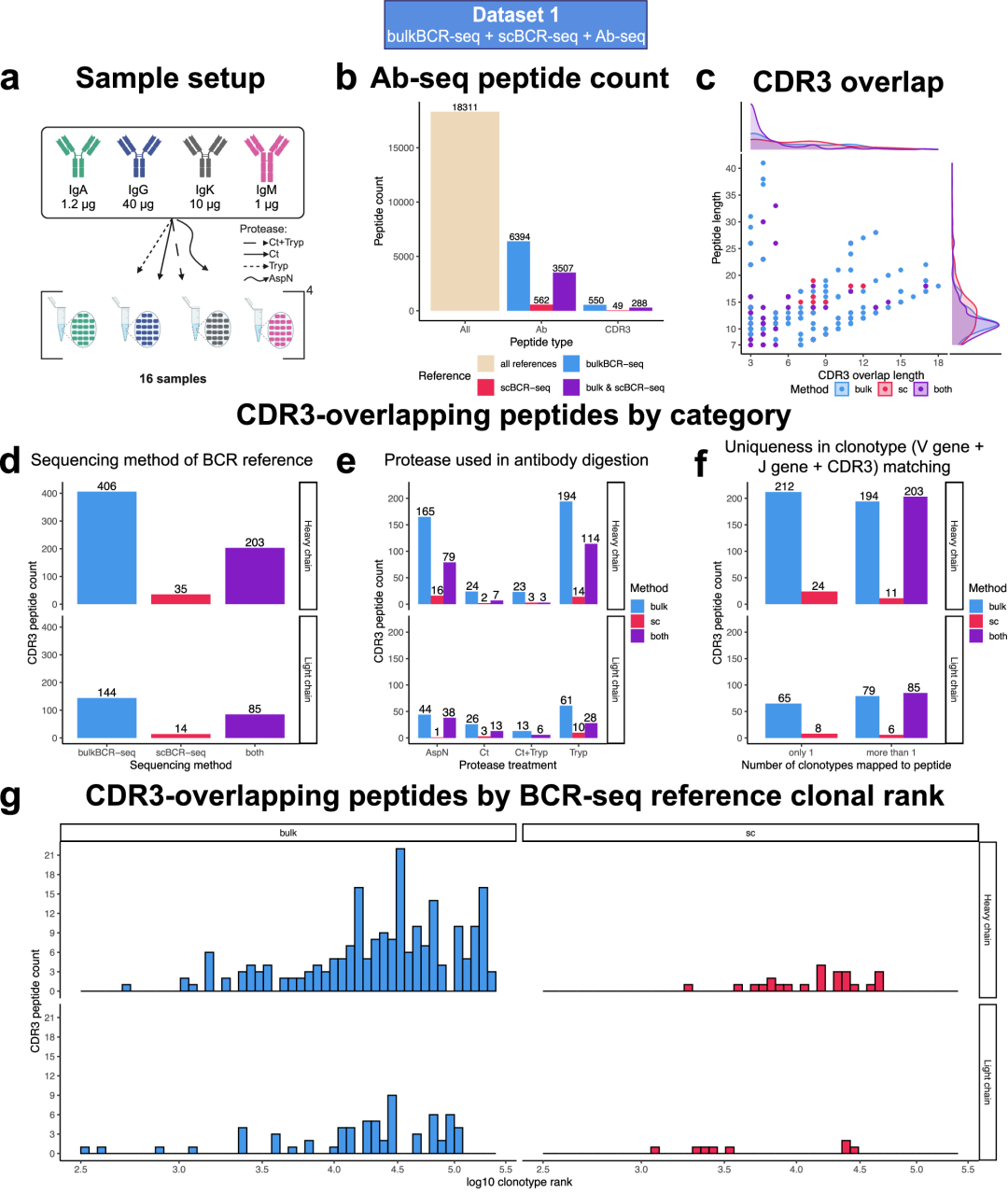
图2
通过将Ab-seq肽映射到BCR-seq参考克隆型,从唯一定位的 CDR3 重叠肽中,可以检索到来自参考克隆型的序列信息,包括 VJ基因名称、CDR3序列以及该克隆型的完整V(D)J序列。无论是bulkBCR-seq还是scBCR-seq,均能获得Ab-seq肽映射的单链的V(D)J序列,scBCR-seq还可以鉴定相同B细胞的配对链的V(D)J序列。(图3)

图3
总之,虽然在Ab-seq中只有一小部分质谱肽段可用于克隆型鉴定,而且大多数Ab-seq肽段都映射到了BCR基因库中扩展较少的克隆型,但利用BCR-seq参考库扩展的Ab-seq技术直接从血清抗原抗体中恢复V(D)J序列是可行的。特别是利用scBCR-seq 参考库,配对链V(D)J序列重建也具有相当的可信度。

该研究证明了bulkBCR-seq和scBCR-seq都适合表征个体的VH基因使用谱,而克隆序列重叠程度受到采样深度变化的显著影响。另外利用BCRseq文库作为Ab-seq的参考,作者证明了从循环中的短肽重建完整V(D)J序列的可行性。该研究结果证明了整合互补方法在多个层面上探索体液免疫系统的可行性。

标题:LC-MS/MS结合免疫组库鉴定SARS-CoV-2 S蛋白中和表位特异性抗体的新策略
发表期刊:Molecular Biomedicine
发表时间:2022年7月
作者创建了一种新策略来有效获得针对SARS-CoV-2的中和抗体或中和抗体的CDR3区,采用蛋白质质谱法分析中和抗体抗原结合区(可变区)的肽序列,并分选B细胞进行高通量BCR测序。然后将中和抗体可变区的肽序列映射到完整的BCR库中,并找到中和抗体的整个可变区序列。最后,作者获得并合成了大量中和抗体的CDR3肽,可以证实其对SARS-CoV-2感染的中和活性。

首先采用生物信息学方法预测病毒刺突蛋白的受体结合域(RBD)的B细胞抗原表位及其邻近区域,选取4个候选表位合成并制备亲和层析柱。使用这些亲和层析柱从恢复期COVID-19患者的血清中纯化与不同表位结合的IgG。然后,用蛋白质质谱分析其可变区序列的肽信息。另外分选患者外周血B细胞进行BCR测序,将质谱得到的序列和BCR库的序列进行定位,得到IgG可变区的整个基因序列。进而鉴定IgG CDR3的中和活性。(图1)

图1
从15例恢复期患者中获得27131条IG重链和轻链V(D)J序列,其中365条序列仅存在于9例有中和抗体的恢复期患者中。随后,将与E1、E2、E3和S1蛋白结合的中和抗体的可变区的肽序列与同一个体的BCR V(D)J序列进行图谱分析,发现15个恢复期患者中有10个显示肽序列与基因序列之间的一一匹配。此外,有55个序列在具有中和抗体的患者中由多个个体共享,但在没有中和抗体的患者和健康人中不存在(图2)。这些数据表明作者获得了中和抗体的整个序列。然后作者通过模型验证了这种方法分选的CDR3肽可以在体外成功阻断SARS-CoV-2感染。

图2

作者开发了一种新的研究方案,将质谱与免疫组库基因测序相结合,可以快速获得抗体的整个可变区域序列,可用于构建SARS-CoV-2特异性抗体库。该新方案也适用于快速筛选其他病原微生物的中和抗体。

标题:重症肌无力亚型中IgG可变区的N-连接糖基化升高
发表期刊:Journal of Immunology
发表时间:2021年10月
免疫球蛋白G可变区(IgG-V)的N-连接糖基化升高(IgG-VN-Glyc)是一种与自身免疫性疾病相关的新兴分子表型。作者通过蛋白质组学和BCR测序研究了重症肌无力(MG)患者血清IG和BCR库中IgG-VN-Glyc的特征,然后通过质谱法和抗原结合测定法验证MG自身抗原特异性单克隆抗体的N-连接糖基化位点占据率以及它是否影响抗原结合。

N-连接的糖基化位点仅出现在具有基序(N-X-S/T,其中X=非脯氨酸)的氨基酸序列位置处。分别对MuSK MG患者、AChR MG患者和健康对照受试者进行PBMC BCR测序,筛选IgG亚型序列。与健康对照组(10.3%)相比,AChR MG(13.0%)和MuSK MG(17.4%)的中位IgG-VN-Glyc位点频率显著升高(图1A)。
为了研究这种频率升高是通过优先使用编码N-X-S/T基序的三个 VH基因片段(IGHV4-34、IGHV1-8 和 IGHV5-10-1)还是通过SHM产生的,作者评估了VH基因片段germline reversion中该基序的频率(图1B),与健康对照相比,AChR MG患者的IgG-V位点种系频率无差异,而MuSK MG组显著升高。说明AChR MG患者IgG-VN-Glyc位点频率升高是来自SHM,而MuSK MG患者的频率升高是SHM和特定V基因使用频率增加的共同作用。

图1
然后作者通过蛋白质组学研究发现一部分MG患者在Fab区域具有非典型IgG糖基化,可能是由于IgG-VN-Glyc,这在很长一段时间(3-4 年)内似乎是一个稳定的特征。
接下来作者通过质谱分析验证了三种患者来源的单克隆抗MuSK 抗体(MUSK1A、MUSK1B、MUSK3-28)和一种患者来源的单克隆抗AChR抗体(单克隆抗体637)中的N-糖可变区占有情况(图2)。发现所有三种MuSK自身抗体都是糖基化的,并且突变的变体的异质性显著降低,质量轻约2kDa(图2A-C)。由于N-聚糖是极不均一的分子部分,含有IgG-VN-Glyc的蛋白质具有升高的质谱异质性。这些发现证实了糖基化的存在,AChR抗体也得到类似的结果(图2D)。总之,MG 中的自身抗原特异性抗体(mAbs)在其IgG可变区可能含有被占据的N-糖基化。

图2
最后作者测试了IgG-VN-Glyc对MG mAb结合的影响,发现IgG-VN-Glyc的丢失不影响三种抗MuSK mAb或抗AChR mAb与其各自靶标的结合。

该研究证明了在AChR和MuSK MG患者的总循环IgG和B细胞受体库中存在IgG-VN-Glyc升高,且其不影响AChR或MuSK自身抗体结合。这有助于理解IgG-VN-Glyc的基本生物学及其与疾病的关联。

参考文献:
Lê Quý K, Chernigovskaya M, Stensland M, et,al. Benchmarking and integrating human B-cell receptor genomic and antibody proteomic profiling. NPJ Syst Biol Appl. 2024 Jul 12;10(1):73.
Yu M, Zhu Z, Wang Y, et,al. A new strategy: identification of specific antibodies for neutralizing epitope on SARS-CoV-2 S protein by LC-MS/MS combined with immune repertoire. Mol Biomed. 2022 Jul 5;3(1):20.
Mandel-Brehm C, Fichtner ML, Jiang R, et,al. Elevated N-Linked Glycosylation of IgG V Regions in Myasthenia Gravis Disease Subtypes. J Immunol. 2021 Oct 15;207(8):2005-2014.


ImmuHub®部分科研方向

ImmuHub®适用基因座

部分数据分析结果展示
杭州艾沐蒽生物科技有限公司成立于2016年,是国际前沿的专注于免疫驱动医学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组基因高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®肿瘤早筛、单细胞测序、TCR-T和抗体发现等平台管线。目前为止发表了数十篇论文,其中包括:The New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)等多篇高分杂志。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论