 后台回复“资料”,生物医药资料大合集,限时领取
后台回复“资料”,生物医药资料大合集,限时领取
阿尔茨海默病、帕金森病等影响大脑认知功能的疾病,在老年人中高发。科学家们经过多年研究发现,脑中有一类细胞的行为失常可能是导致或加重这类神经退行性疾病的幕后凶手:小胶质细胞(microglial cell)。
先天免疫补体蛋白C1q,作为小胶质细胞特异的产物,展现出大脑功能调控的特异性角色。随着年龄增长,C1q在大脑中的表达显著上调,而C3等其他补体蛋白则保持低水平,提示C1q可能具有独立于经典补体途径、年龄相关的独特脑功能。
最近发表于《细胞》上的一篇名为 Microglial-derived C1q integrates into neuronal ribonucleoprotein complexes and impacts protein homeostasis in the aging brain 的研究论文,科学家发现了小胶质细胞影响神经元功能的一种新方式,而这种方式与衰老密切相关,可能在随年龄增长而发生的认知变化和神经退行性疾病中发挥作用。

研究表明,C1q在脑实质、突触及特定神经元亚群中的积累,与增强海马体可塑性、减缓认知衰退相关,这些效应并不依赖于补体途径或成年突触消除的常规机制。
为进一步探索C1q在神经元功能中的全貌,作者采用无偏倚蛋白质组学方法,对发育期、年轻及成年脑组织的突触体进行C1q免疫共沉淀分析。
结果显示,C1q与核糖体蛋白及RNA结合蛋白(RBP)存在年龄特异的相互作用,并富集于神经元核糖核蛋白(RNP)复合物中。
这些RNP复合物中的许多蛋白质具有液-液相分离(LLPS)倾向,通过所谓的“内吞作用”,神经元可以吸收细胞外的C1q蛋白;而C1q蛋白的特殊结构,尤其是胶原样结构域,则对于神经元摄取C1q蛋白非常关键。
而C1q本身在体外也展现出RNA依赖性的LLPS现象,且与神经元内RNP复合物的共定位同样依赖RNA。
C1q的缺失导致大脑蛋白质稳态、学习记忆能力的年龄特异性变化,揭示了这些相互作用的功能重要性。
研究首次揭示了非神经元来源的免疫蛋白C1q如何整合入神经元RNP复合物,进而影响细胞内活动,挑战了传统对神经免疫相互作用的认知。
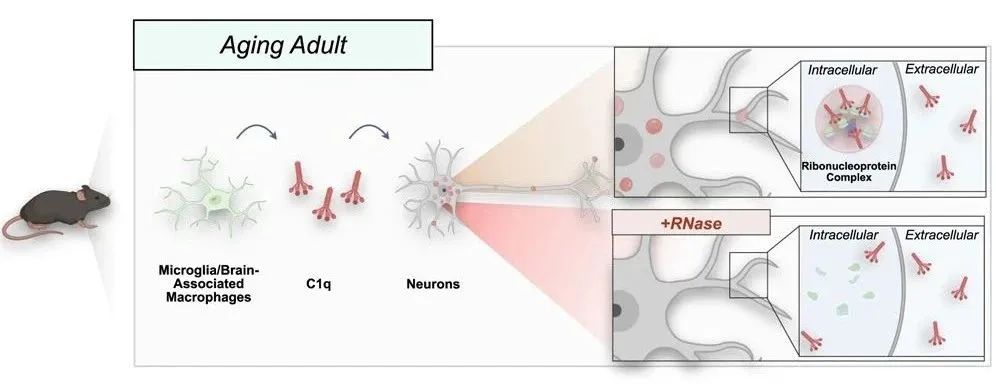
成年小鼠中,随着年龄增长,小胶质细胞分泌的C1q进入神经元,并通过结合核糖核蛋白干扰蛋白质翻译
一旦C1q被内化,其如何逃逸内体区室并整合至神经元RNP复合物的机制同样值得深入研究。
作者推测,C1q的球状头结构域中富含的带电和疏水肽可能类似于某些病毒蛋白的“蛋白质转导结构域”,促进内体逃逸并稳定地与RNP复合物结合。此外,BANF1作为C1q的相互作用蛋白,可能在内体逃逸后保护C1q及RNP复合物免受自噬降解,从而维持其在细胞质中的稳定性。
鉴于在多种神经退行性疾病中发现经历LLPS的蛋白质突变,推测C1q可能通过参与应激颗粒的组装,隔离并防止有毒蛋白质的扩散,从而在维持细胞内稳态中发挥重要作用。这一假设得到了C1q在全基因组筛选中被鉴定为调节应激颗粒组装基因的支持。
进一步地,C1q与BANF1等蛋白的相互作用可能不仅限于保护RNP复合物,还可能涉及对病理性蛋白质如tau蛋白的调控,从而维护突触功能的健康。
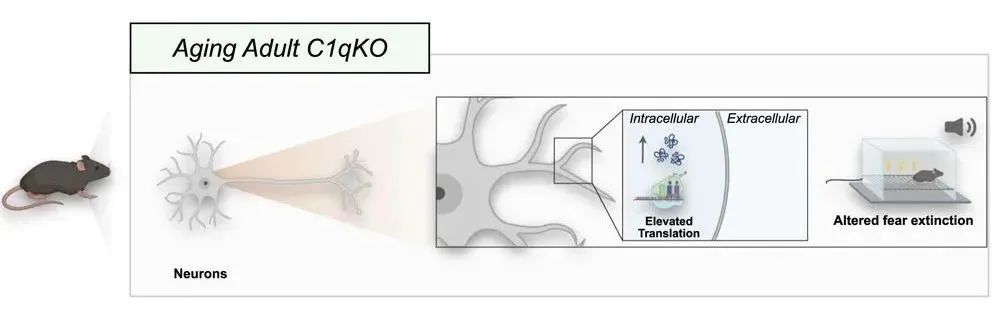
缺少C1q的成年小鼠,记忆消除的时间变长了
这项研究不仅揭示了C1q在神经元内的年龄依赖性和RNA依赖性功能,还强调了神经胶质细胞与免疫衍生蛋白在健康和疾病中复杂而精细的时空调控作用。这些发现为理解神经退行性疾病的发病机制及开发潜在治疗策略提供了新的视角和线索。
未来研究应聚焦于C1q的内化机制、其在RNP复合物中的整合方式及功能影响,以及这些机制如何与衰老或疾病过程相关联。此外,该发现也为理解神经免疫与神经胶质相互作用的进化适应、时间调控的RNA-蛋白质相互作用如何促进这些功能提供了新的视角和研究方向。
免责声明





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论