近年来,蝙蝠作为多种病毒的携带者和潜在宿主,对人类健康构成了巨大威胁,同时蝙蝠与病毒共存而不发病的独特现象引起了科学界的广泛关注。虽然对蝙蝠的固有免疫反应已有所了解,但其适应性免疫机制尚待揭开神秘面纱。
继2023年4月艾沐蒽助力遵义医科大学姚新生教授团队发表国际首篇免疫组TCR测序研究成果(New insights into the germline genes and CDR3 repertoire of the TCRβ chain in Chiroptera)之后,现又助力发表了国际首篇蝙蝠免疫组IGH测序论文“Landscape of IGH germline genes of Chiroptera and the pattern of Rhinolophus affinis bat IGH CDR3 repertoire”的文章,该研究使用艾沐蒽生物ImmuHub®BCR分析系统深入探索四种蝙蝠免疫球蛋白重链(IGH)互补决定区3(CDR3)的特征,为理解蝙蝠如何无症状地携带高致病性病毒提供了重要线索,并可能为开发针对病毒的新疗法开辟新途径。



本研究首次采用python和R语言等制作了蝙蝠IGH参考胚系基因库,通过5‘RACE法进行了IGH CDR3的建库,采用illumina的高通量测序和构建的MiXCR工具进行对蝙蝠CDR3库的特征分析,揭示了蝙蝠免疫球蛋白基因在进化上的独特性及其与人类、小鼠等物种之间的差异,为研究蝙蝠IGH的特性及其抗病毒免疫反应机制提供了新的技术和基础数据。
研究团队通过对蝙蝠免疫球蛋白重链(IGH)基因座进行分析,发现马铁菊头蝠(Rhinolophus ferrumequinum, RF)、苍白矛吻蝠(Phyllostomus discolor, PD)和伏翼三种蝙蝠(pipistrelus pipistrelus, PP)三种蝙蝠的IGH重链长度差异明显(分别为430kb、2500kb和350kb),这可能与PD中IGHV基因的远距离分布有关。RF有41个IGHV基因、4个IGHD基因和6个IGHJ基因,PD有81个IGHV基因(含22个反向基因)、16个IGHD基因和7个IGHJ基因,PP有57个IGHV基因、7个IGHD基因和6个IGHJ基因。三个物种均携带编码IgM、IgG、IgE和IgA四种免疫球蛋白的IGHC基因。
三种蝙蝠的所有V基因在框架区域有保守的氨基酸结构,如Cys23、Trp41和Cys104。研究团队将蝙蝠的IGHV基因分为多个家族,其中RF的41个基因分为6个家族,PD的81个和PP的57个基因各分8个家族,每组含2个假基因家族。通过与IMGT数据库中20多个物种对比,发现蝙蝠IGHV基因在数量、功能基因、假基因和多基因家族的构成上与其它物种有显著差异,这种差异可能表明IGHV基因在蝙蝠体内的显著扩展或扩散。进一步分析发现三种蝙蝠的IGHV基因与人类和小鼠相似,但与鸟类或原始哺乳动物差异较大。此外,在共19个IGHJ基因中,除2个基因有1个突变外,其余IGHJ序列均具有WGQG和VTVS结构,与IMGT数据库中记录的其他哺乳动物基本一致,说明蝙蝠的IGH基因符合真实哺乳动物的标准模式,但与鸟类或原哺乳动物不同。
RSS特征
研究发现的V和J基因前后的重组信号序列(RSS)均为经典的RSS,且三种蝙蝠的RSS序列无论是七聚体还是九聚体,保守位点都比较类似。与人类和小鼠相比,核苷酸保守位置基本一致,结果表明蝙蝠RSS序列与哺乳动物经典的RSS序列一致,在物种进化过程中并未发生较大的变化。

图1
IGH CDR3长度分布与克隆多样性分析
研究团队将中华菊头蝠(Rhinolophus affinis, RA)与人和小鼠IGH CDR3序列进行对比分析,发现在RA的IGH CDR3序列中,IgG亚类所占比例最大,其次是IgM、IgA和IgE。在转录组水平上,蝙蝠的IGH CDR3亚型与人和小鼠存在显著差异,例如IgA的比例极低。蝙蝠在亚型上不同于人类和小鼠的特征可能是蝙蝠特殊免疫反应。
研究团队对三个物种的V使用频率对比分析,结果显示三个物种都偏向IGHV1,其次是IGHV4(除小鼠外),而IGHV3仅在蝙蝠中以较高频率出现;对J基因使用频率对比分析,结果显示IGHJ4在三个物种中频繁出现,且蝙蝠和人类IGHJ家族的使用频率相近,依次为IGHJ4、IGHJ6、IGHJ5、IGHJ3、IGHJ1和IGHJ2,小鼠则无明显偏好(图2)。
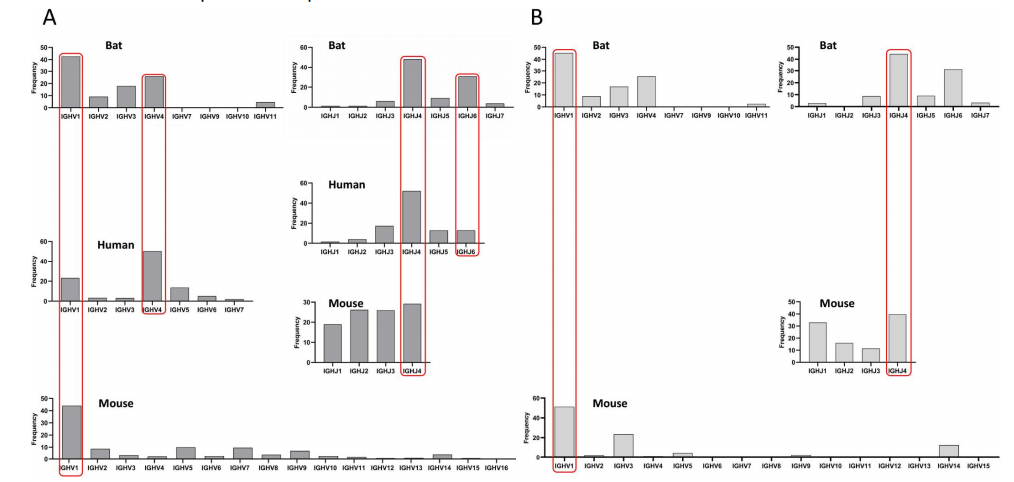
图2
IGH CDR3长度分布与克隆多样性分析
研究发现在蝙蝠、小鼠和人类中,IgA、IgG和IgM的CDR3长度呈钟形分布,蝙蝠以13,15,14 AA为中心,小鼠以15,15,13 AA为中心,人类以16,17,16 AA为中心。此外,蝙蝠的CDR3区域存在较高的插入和删除率,并且其V、D和J基因的组合也与人类和鼠有所不同。
研究团队通过对比蝙蝠与人和小鼠的克隆发现,蝙蝠中罕见克隆的比例显著低于人类和小鼠,且蝙蝠个体间的差异较大。Shannon指数表明,蝙蝠中IGH CDR3库多样性相对低于人类和小鼠。此外,通过测序检测到蝙蝠和小鼠之间有14个共有克隆型。
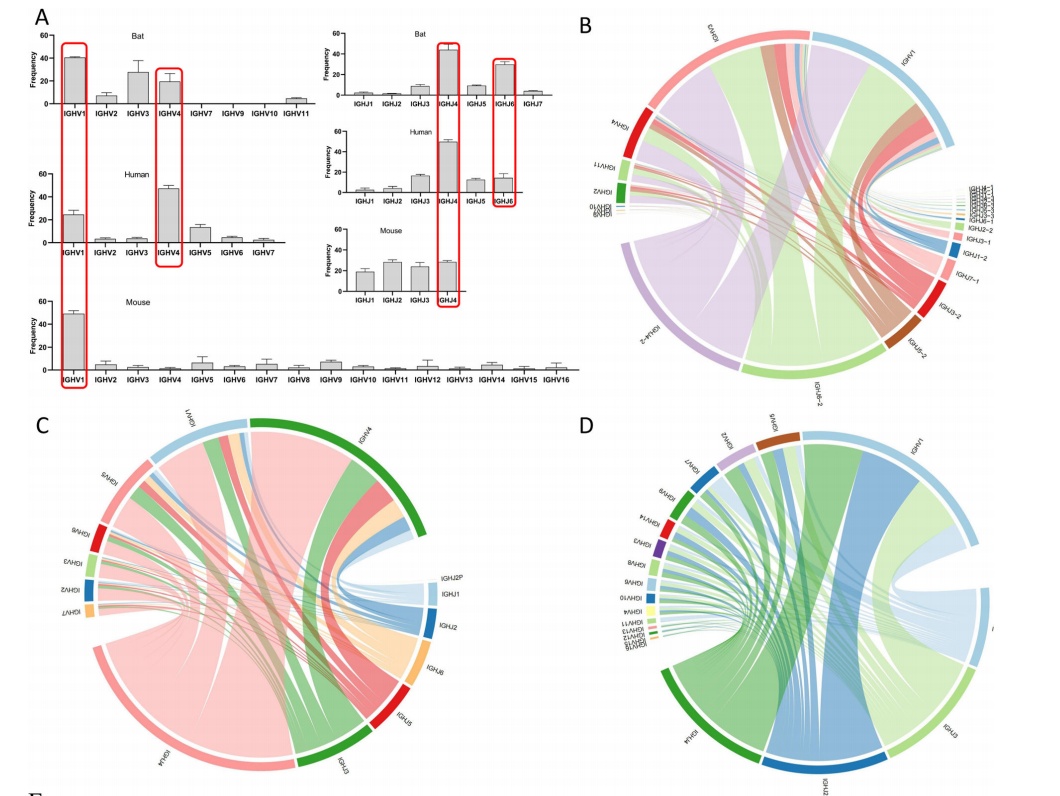
 图3
图3
IgG、IgA和IgM在氨基酸使用上与人类和小鼠高度一致,高频使用Y、G、A、R、W和D,且蝙蝠和小鼠之间存在多个相同高频率的基序,而蝙蝠和人类只有一个相同高频率的基序(图4B),说明蝙蝠IgE和IgA的分类转换机制不一致。研究团队进一步分析了蝙蝠的四个亚类,发现IgA和IgE具有多个独特的高频基序,而IgM和IgG具有几乎相同的高频基序。此外,蝙蝠J区SHM明显高于人和小鼠(图4C),研究团队猜测蝙蝠较高的 SHM 可能与其对病毒的耐受性或反应密切相关。

图4

研究通过高通量BCR测序对4种蝙蝠的免疫球蛋白重链(IGH)胚系基因进行详尽分析,首次绘制了蝙蝠IGH参考胚系基因库,并解析了中华菊头蝠IGH CDR3库的特性。研究发现,蝙蝠的IGH CDR3库在多个方面表现出独特性,包括CDR3亚类、V/J基因使用和配对模式、CDR3克隆类型以及体细胞高频突变,这些特征可能是蝙蝠能够携带高致病病毒而避免发病的原因之一。此外,蝙蝠IGH J序列的体细胞高频突变率显著高于人类和小鼠,这可能反映了蝙蝠特有的适应性免疫策略,用以应对病毒威胁。
该研究为理解蝙蝠如何与病毒共存而避免发病提供了重要线索,使研究者们能够更深入地分析蝙蝠免疫受体的多样性,为开发创新的抗病毒治疗策略提供了宝贵的资源。

参考文献:Ma L, Liu L, Li J, Zhou H, Xiao J, Ma Q, Yao X.2024.Landscape of IGH germline genes of Chiroptera and the pattern of Rhinolophus affinis bat IGH CDR3 repertoire. Microbiol Spectr12:e03762-23.https://doi.org/10.1128/spectrum.03762-23.

ImmuHub®部分科研方向

ImmuHub®适用基因座

部分数据分析结果展示
杭州艾沐蒽生物科技有限公司成立于2016年,是国际前沿的专注于免疫驱动医学技术的国家高新技术企业。创始人团队来自美国芝加哥大学,在2010年开始使用免疫组基因高通量测序技术开展各种疾病相关研究,于2016年通过自主研发,全国首家推出NGS-MRD血液肿瘤微小残留病(MRD)检测Seq-MRD®,并授权泛生子使用。同时,公司拥有Immun-Traq®肿瘤治疗伴随诊断、Immun-Cheq® |T细胞免疫测评以及ImmuHub®免疫组测序科研服务产品,并布局有基于AI机器学习算法的T-classifier®肿瘤早筛、单细胞测序、TCR-T和抗体发现等平台管线。目前为止发表了数十篇论文,其中包括:The New England Journal of Medicine(IF:158.5), Nature(IF:65), Signal Transduction and Targeted Therapy(IF:40), Cellular and Molecular Immunology(IF:24), Nature Communications (IF:17)等多篇高分杂志。公司构建几十项发明专利和软件著作权为核心的自主知识产权体系,为医院临床、生命科学研究、新药开发等提供解决方案和产品。艾沐蒽专注于通过解码适应性免疫系统来改变疾病的诊断和治疗,并致力于推进免疫驱动医学领域发展。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论