
近期,由中山大学肿瘤防治中心刘孟忠、胡永红、习勉教授团队开展的首个抗PD-1单抗联合根治性放化疗(CRT)用于局部晚期食管鳞癌(ESCC)的前瞻性II期临床研究——EC-CRT-001研究的长期生存及事后探索性分析结果正式发表在国际著名期刊《柳叶刀》子刊—— eClinicalMedicine期刊1 。该研究作为首个证实抗PD-1单抗特瑞普利单抗联合根治性CRT在局部晚期食管鳞癌患者具有令人鼓舞的疗效和良好的安全性的临床研究,其主要结果及生物标志物分析结果分别于2023年3月和2024年3月相继发表在国际权威期刊《柳叶刀·肿瘤学》(The Lancet Oncology)和《自然-通讯》 (Nature Communication)(点击查看相关报道),为免疫治疗在局部晚期食管癌的应用提供了有力证据,有望改变临床实践。
此次该研究的长期随访结果发表,是首个对于局部晚期ESCC患者使用特瑞普利单抗联合根治性CRT治疗的超3年随访数据,结果显示特瑞普利单抗联合CRT为患者带来了长期生存获益,再次证实了之前的研究结果。中位总生存期(OS)为26.9个月,3年OS率达44.8%,3年无进展生存(PFS)率达35.7%,进一步突显了免疫检查点抑制剂(ICI)与CRT联用在局部晚期ESCC中的实力。此外,研究者对免疫相关不良事件(irAE)及疾病复发模式进行了分析,以期优化ESCC个体化治疗和治疗监测策略。研究发现,irAE的发生与患者长期临床获益有关,irAE可能是临床疗效的重要预测因素,并识别出GON4L基因突变可能是潜在的irAE状态预测生物标志物。
本文通讯作者是中山大学肿瘤防治中心的习勉教授,王蕊希、凌逸虹、陈宝清为本文共同第一作者。

研究背景
食管癌是全球癌症相关死亡的主要原因之一,尤其是ESCC在东亚地区的发病率较高,局部晚期不可切除ESCC患者的预后较差。目前,根治性CRT是不可手术的局部晚期 ESCC 患者的标准治疗方案,但其在长期生存改善方面有限,亟需更有效的治疗策略。以抗PD-(L)1抗体为代表的ICI与化疗联用方案已在晚期ESCC中显示出显著的生存改善并成为主要的治疗手段,但其在局部晚期ESCC中的作用尚未明确。EC-CRT-001研究中,特瑞普利单抗联合根治性CRT治疗局部晚期ESCC显著提升缓解率,放疗后3个月的完全缓解(CR)率达62%,明显优于目前的标准疗法;此外,中位PFS为12.2个月,1年OS率与PFS率分别为78.4%和54.5%,且耐受性良好2。目前,多项ICI联合CRT用于局部晚期ESCC的研究正在进行中,但缺乏长期生存数据。此次,EC-CRT-001研究团队报告了该项II期试验的3年OS和PFS更新数据,并进行了事后探索性分析以明确疾病复发模式、irAE与疗效之间的相关性以及irAE的潜在预测生物标志物。
研究设计
EC-CRT-001研究是一项开放、单臂II期临床研究(NCT04005170),纳入不可切除的I-IVA期ESCC患者,治疗方案包括化疗(紫杉醇50mg/m²+顺铂25mg/m²,QW)治疗5个周期,同步胸部放疗(50.4 Gy/28次)及特瑞普利单抗(240 mg,Q3W,治疗持续最长时间为1年)治疗。主要终点为放疗结束3个月的CR率,次要终点包括OS、PFS和安全性。此外,探索性目标包括复发模式的分析、irAE与疗效的相关性以及irAE潜在预测因子的评估。
研究结果
自2019年11月至2021年1月期间,研究共入组42例患者,其中26例(62%)患者经特瑞普利单抗联合根治性CRT治疗后达到CR。CR组与非CR组患者的基线特征见表1。较早的cTNM分期(P = 0.00034)、N0-2期(P=0.017)以及原发肿瘤直径较短(P=0.026)的患者与更高的CR率显著相关。
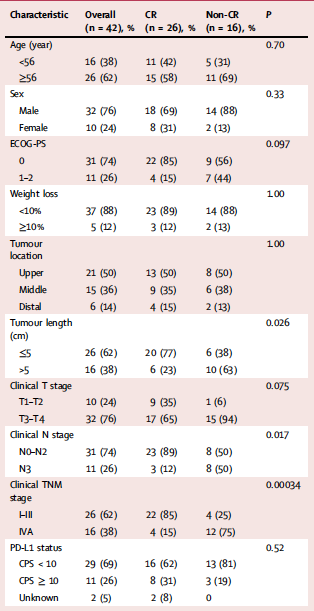
表1 患者人口统计学和临床特征
长期生存结局:特瑞普利单抗联合根治性CRT显著改善生存获益,3年OS率达44.8%
中位随访时间为44.3个月,中位OS为26.9个月(95% CI 8.7–45.2),3年OS率为44.8%(95% CI 31.9%-62.8%);中位PFS为12.2个月(95% CI 8.3–16.1),3年PFS率为35.7%(95% CI 23.8%-53.6%)(图1A、B)。此外,3年无局部复发生存 (LRFFS) 率和3年无远处转移生存(DMFS) 率分别为46.3% 和67.8%。
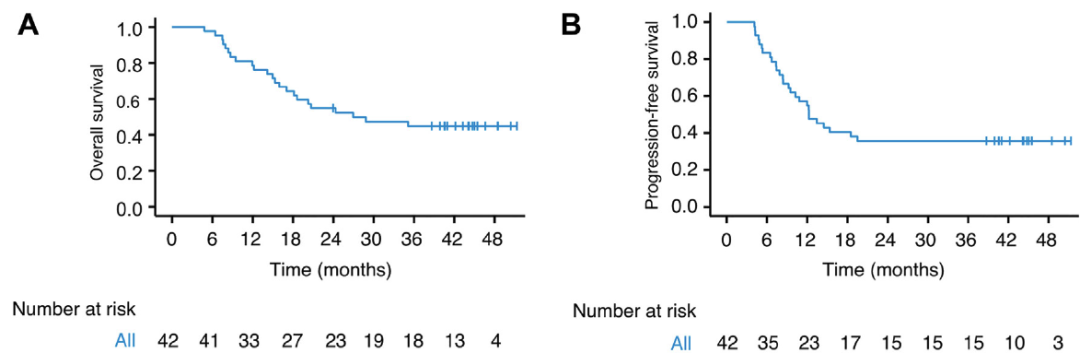
图1 整体人群的OS(A)和PFS(B)
生存预后因素:实现CR的患者OS更优,肿瘤应答(CR与非CR)是OS和PFS的唯一独立预后指标
关于肿瘤应答对长期生存影响的事后分析结果显示,达到CR患者的OS(HR=13.73, P<0.0001)、PFS(HR=32.08, P<0.0001)、LRFFS(HR=43.60, P<0.0001)和DMFS(HR=5.35, P=0.0038)均显著优于未达到CR的患者。
预后因素的单因素和多因素分析表明,肿瘤应答(CR与非CR)是OS(HR=9.90, P=0.00089)与PFS(HR=24.85, P<0.0001)的唯一独立预后指标。
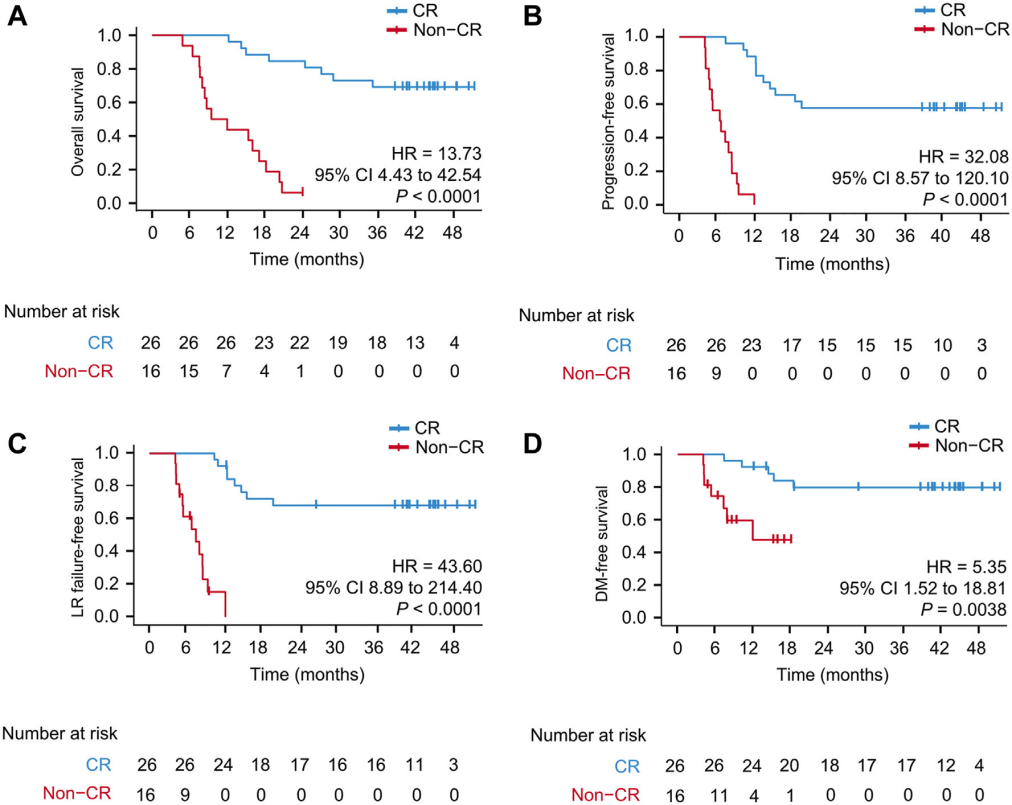
图2 CR与非CR患者的OS(A),FPS(B),LRFFS(C)和DMFS(D)
复发模式、时间和部位:实现CR的患者疾病复发率更低、复发时间更晚
42例患者中有23例(55%)在随访期间发生了疾病复发,其中局部复发是最常见的复发模式(11例,26%),24%的患者同时发生局部复发和远处转移。CR组局部复发率显著低于非CR组(31% vs. 81%,P=0.0036)。首次中位复发时间为8.4个月,非CR组的首次中位复发时间明显早于CR组(6.6 vs. 12.8个月,P<0.0001)(表2)。值得注意的是,在随访的第一年内,非CR组患者均发生疾病复发,复发率为100%(13/13),而CR组仅30%(3/10)的患者复发,两组存在显著差异(P=0.00097)。
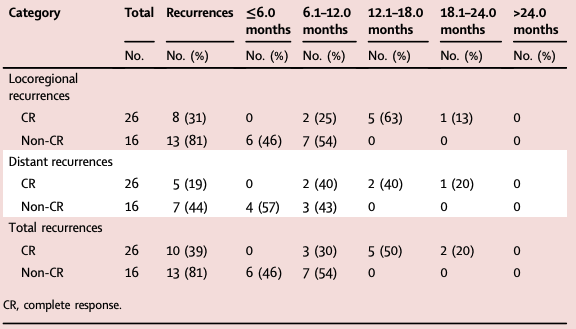
表2 CR与非CR组的复发时间与频率
irAE 状态与肿瘤应答和生存结局相关性:irAE的发生与治疗效果呈正相关,GON4L基因突变是irAE状态潜在预测生物标志物
研究团队对irAE状态与临床结局之间的相关性进行了探索性事后分析。结果显示irAE的发生与治疗效果呈正相关,发生irAE的患者具有更高的CR率(P=0.082)以及更好的PFS(P=0.027),但irAE状态并不能显著预测OS结果(P =0.23)(图3A、B、C)。
此外,研究者整合全基因组测序和RNA测序分析发现,GON4L基因突变与较低的irAE发生率显著相关(P=0.036)(图3D),提示该突变可能通过抑制免疫反应,从而减少irAE的发生,可作为预测irAE发生的潜在生物标志物。
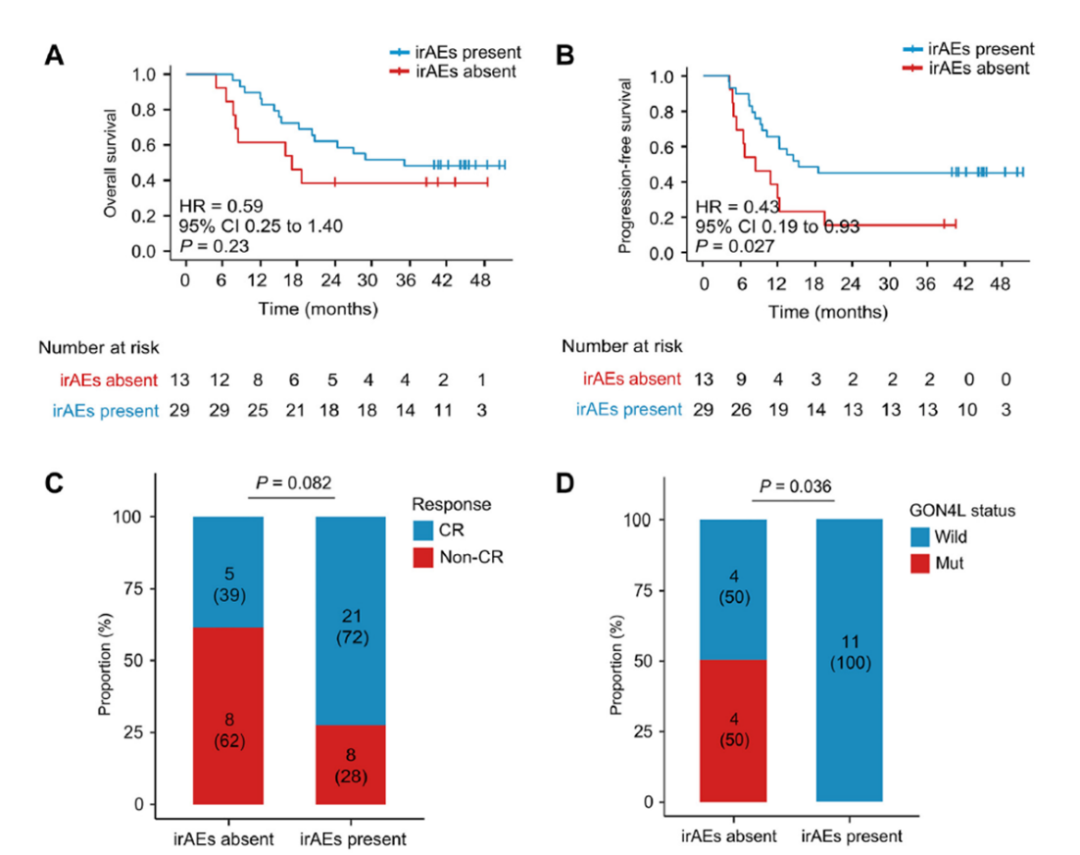
图3 irAE状态对生存、肿瘤应答和基因组的影响:OS(A)、PFS(B)、CR(C)与GON4L状态(D)
研究结论
EC-CRT-001研究最新3年生存随访结果证实了特瑞普利单抗联合根治性CRT在局部晚期ESCC中的疗效和生存获益,为特瑞普利单抗在局部晚期ESCC中的长期疗效提供了有力的证据支持。此外,irAE的发生可能预示着更佳的预后。CR与非CR患者在复发模式、时间和频率上的差异表明了对于局部晚期ESCC患者,个体化治疗监测策略是必要的。未来需进一步研究以验证这些发现,并探索如何优化个体化治疗和监测策略。
参考文献:
Wang R, Ling Y, Chen B, et al. Long-term survival and post-hoc analysis of toripalimab plus definitive chemoradiotherapy for oesophageal squamous cell carcinoma: insights from the EC-CRT-001 phase II trial. EClinicalMedicine. 2024 Aug 30;75:102806.
Zhu Y, Wen J, Li Q, et al. Toripalimab combined with definitive chemoradiotherapy in locally advanced oesophageal squamous cell carcinoma (EC-CRT-001): a single-arm, phase 2 trial. Lancet Oncol. 2023 Apr;24(4):371-382.


声明
 点击“阅读原文”,查看发表文章原文
点击“阅读原文”,查看发表文章原文




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论