2024年10月2日至4日,2024年第43届欧洲外科肿瘤学会(ESSO)年会在比利时安特卫普举行。由复旦大学附属肿瘤医院章真教授牵头开展的短程放疗(SCRT)联合特瑞普利单抗和化疗新辅助治疗早期直肠癌的II期TORCH-E研究入选本届大会口头报告,复旦大学附属肿瘤医院李心翔教授在大会上口头报告了研究详细数据,引发广泛关注和讨论。该研究表明,基于SCRT联合特瑞普利单抗和化疗的创新疗法用于错配修复完整或微卫星稳定(pMMR/MSS)的低位早期直肠癌患者新辅助治疗,可显著提高完全缓解(CR)率达88.5%,器官保留(OP)率达73.1%,为该类患者实现器官保留提供了极具前景的治疗新选择。
根治性手术是I-Il期直肠癌的标准治疗方法。然而,对于低位早期直肠癌患者,为了降低手术相关的发病率,器官保留可能是更优的选择。相关研究表明术前放化疗联合PD-1抑制剂新辅助治疗在局部晚期直肠癌患者中显示出良好的肿瘤退缩效果,有利于患者实现器官保留。因此,该联合疗法值得在早期直肠癌中进行研究。本研究旨在探索SCRT联合特瑞普利单抗和化疗(卡培他滨+奥沙利铂,CAPOX)治疗早期低位pMMR/MSS直肠癌的疗效和安全性。
该研究结果频频亮相国际大会,先后入选2024年ESMO大会、ASTRO大会(点击查看相关报道),此次又获ESSO大会口头报告,再度证明了这项研究的创新价值及特瑞普利单抗联合疗法的潜力。
TORCH-E研究是一项前瞻性、多中心、单臂、II期临床研究(NCT05555888),研究共纳入34例pMMR/MSS的直肠癌患者(临床分期:cT1-3bN0M0,距肛门边缘≤5cm),接受短程放疗(25Gy/5Fx),之后接受特瑞普利单抗联合CAPOX治疗4个周期,每三周为一个周期。对于达到临床完全缓解(cCR)的患者,可以选择等待观察(WW)方案;而未达到cCR的患者,则建议行手术治疗。主要研究终点为CR率,包括术后病理完全缓解(pCR)和选择WW的cCR。次要终点包括OP率、局部无复发生存(LRFS)率、毒性、依从性、手术并发症及长期预后。
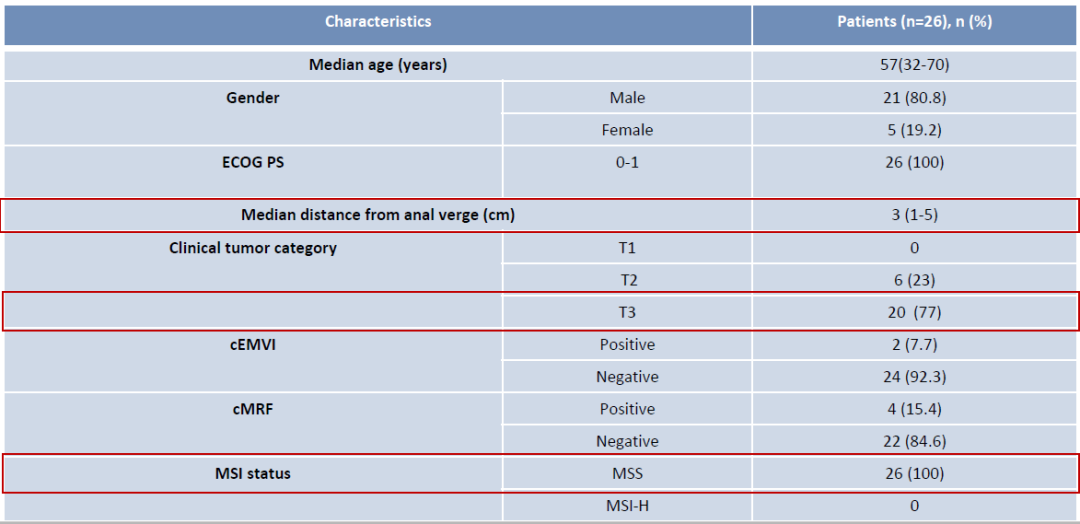
截至2024年4月,26例患者完成了新辅助治疗并纳入分析。中位年龄为57岁,77%(20/26)的患者疾病分期为T3期(直肠MRI诊断),距肛门边缘的中位距离为3cm。
表1. 患者基线特征
26例患者中,13例患者达到cCR并选择了WW方案。其余13例患者接受手术,R0切除率100%。6例患者进行了局部切除且未发现残余肿瘤细胞(ypT0);7例患者进行了全直肠系膜切除术(TME),其中4例确认为病理完全缓解(ypT0N0,TRG0)。经研究者评估,总体CR率达88.5%(23/26),73.1%(19/26)患者实现了器官保留。
表2. 总体疗效
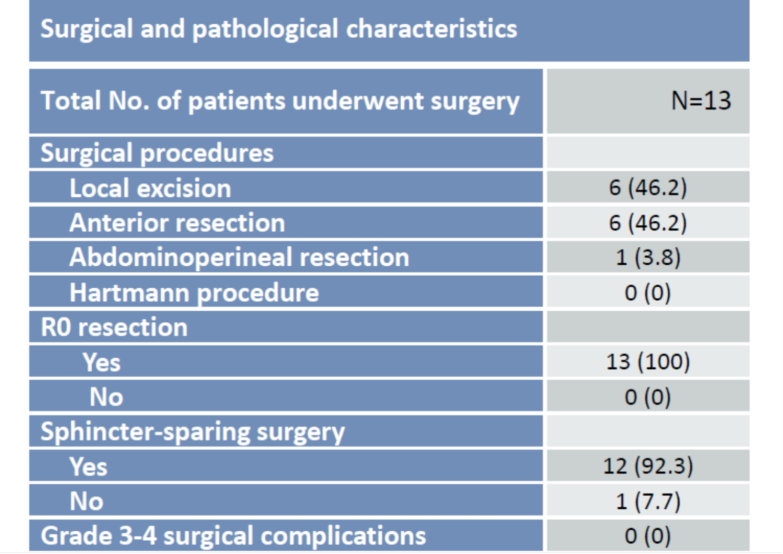
表3. 手术及病理特征
所有患者完成了全剂量放射治疗,依从性为100%。84.6%的患者完成了四个周期的化疗联合特瑞普利单抗治疗,整体治疗依从性较好。

表4. 免疫化疗治疗的依从性
安全性方面,8例患者发生了≥3级不良事件,包括7例(26.9%)血小板减少症和1例(3.8%)白细胞减少症。未发生治疗相关死亡事件。未发生≥3级手术并发症。
该研究表明,对于pMMR/MSS低位早期直肠癌患者,SCRT后接受特瑞普利单抗和化疗新辅助治疗显著提高了CR率和器官保留率,且整体安全性可管理。该创新联合疗法为此类患者通过非手术治疗或微创手术实现器官保留提供了极具前景的治疗新方案,值得进一步开展前瞻性随机试验进行验证。

特瑞普利单抗注射液(拓益®)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。
特瑞普利单抗至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。截至目前,特瑞普利单抗已在中国内地获批10项适应症:用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗(2018年12月);用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗(2021年2月);用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗(2021年4月);联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗(2021年11月);联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗(2022年5月);联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗(2022年9月);联合化疗围手术期治疗,继之本品单药作为辅助治疗,用于可切除IIIA-IIIB期非小细胞肺癌的成人患者(2023年12月);联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗(2024年4月);联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗(2024年6月);联合注射用紫杉醇(白蛋白结合型)用于经充分验证的检测评估PD-L1阳性(CPS≥1)的复发或转移性三阴性乳腺癌的一线治疗(2024年6月)。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有6项获批适应症纳入《国家医保目录(2023年)》,是目录中唯一用于治疗黑色素瘤的抗PD-1单抗药物。2024年4月,香港卫生署药物办公室受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请。在国际化布局方面,2023年10月,特瑞普利单抗已作为首款鼻咽癌药物在美国获批上市。2024年9月,特瑞普利单抗用于晚期鼻咽癌和食管鳞癌的一线治疗获得欧盟委员会批准上市。此外,英国药品和保健品管理局(MHRA)受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请,澳大利亚药品管理局(TGA)和新加坡卫生科学局(HSA)分别受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请。
 君实医学发布资料旨在满足医疗卫生专业人士的医学信息需求,仅作为医学和科研参考,无意向您做任何产品的推广,不作为临床用药指导。君实生物不建议以任何与您所在国家所批准的处方信息不符的方式使用本品。诊疗信息请咨询专业医生。
君实医学发布资料旨在满足医疗卫生专业人士的医学信息需求,仅作为医学和科研参考,无意向您做任何产品的推广,不作为临床用药指导。君实生物不建议以任何与您所在国家所批准的处方信息不符的方式使用本品。诊疗信息请咨询专业医生。
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。









 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论