由CRISPR基因编辑技术奠基人、诺奖得主詹妮弗·杜德娜(Jennifer Doudna)创立的体内基因编辑疗法公司Intellia Therapeutics近日宣布,已启动基于mRNA-LNP的CRISPR体内基因编辑疗法NTLA-2002治疗遗传性血管性水肿(HAE)的全球关键HAELO 3期研究。
NTLA-2002是一种体内CRISPR基因编辑候选疗法,通过脂质纳米颗粒(LNP)以mRNA形式递送CRISPR-Cas9基因编辑系统,靶向敲除KLKB1基因,以永久性抑制激肽释放酶(kallikrein)的产生,进而抑制缓激肽(bradykinin)的产生,而缓激肽的过度产生会导致遗传性血管性水肿(HAE)的发作。
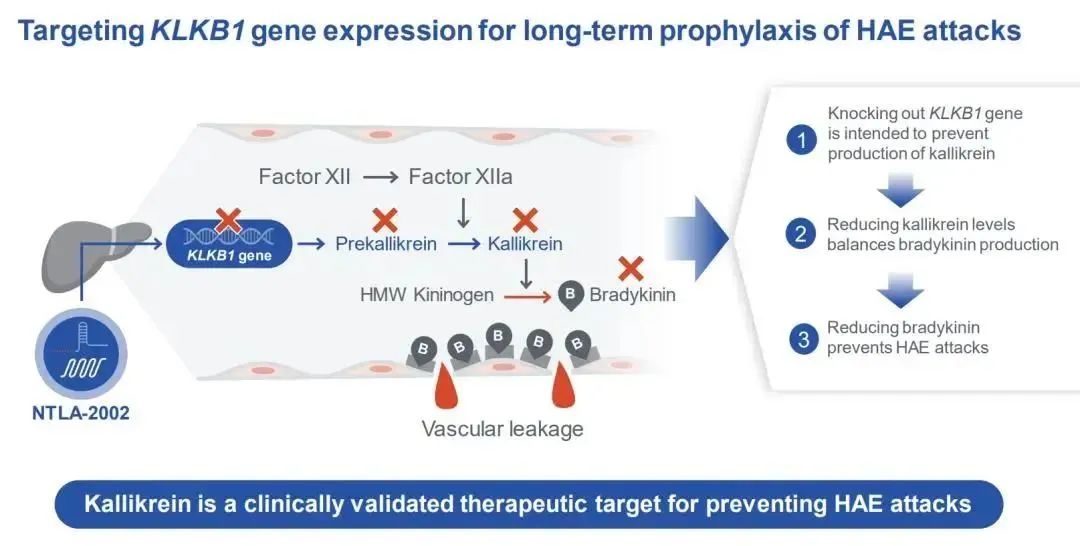
2023年3月2日,Intellia Therapeutics宣布,FDA批准了NTLA-2002的新药临床试验研究(IND)申请。这也是首个获得FDA批准用于人体临床试验的LNP递送的体内CRISPR基因编辑疗法。
不久前,Intellia Therapeutics公布了NTLA-2002 1/2期研究的长期随访数据。在最早接受治疗的患者中,持续超过两年的扩展随访数据进一步强化了NTLA-2002作为遗传性血管性水肿(HAE)患者的潜在功能性治愈方案的潜力。
10名患者中有8名在16周主要观察期结束后的最新随访中仍完全没有发作,包括那些症状最严重的患者。单次NTLA-2002剂量使月度HAE发作率平均减少了98%,所有患者的平均随访时间超过20个月。100%停用预防性治疗的患者在接受NTLA-2002后仍不需要长期预防性治疗。在所有剂量水平下观察到良好的安全性和耐受性。
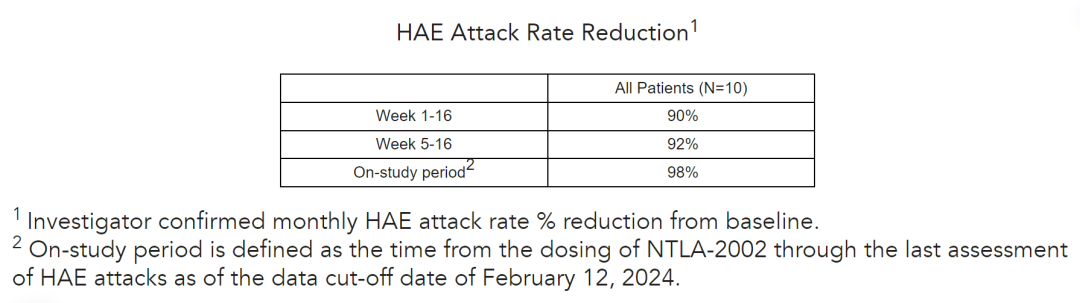
该长期随访数据显示,NTLA-2002有可能成为第一个治疗遗传性血管性水肿(HAE)的一次性治疗方法,达成“一次治疗,终身治愈”的目标。
Intellia总裁兼首席执行官、医学博士John Leonard表示:“HAELO 3期试验的启动对Intellia来说是一个重要的里程碑,标志着我们进入了NTLA-2002用于遗传性血管性水肿患者的临床开发最后阶段。1/2期临床研究数据显示,单剂次治疗就可以带来疾病完全缓解的巨大前景,不再发作,也不需要进一步治疗。我们正在加速NTLA-2002的上市进程,以满足患有该疾病患者的实际需求,并最终相信将为社会健康带来重大价值。”
NTLA-2002已获得多项重要监管认定,包括美国FDA的孤儿药资格认定和RMAT认定,英国药品和健康产品管理局(MHRA)的创新通行证认定,欧洲药品管理局(EMA)的优先药物认定以及孤儿药资格认定,有望加速NTLA-2002的获批上市及后续市场布局。如果研究进展顺利,公司计划在2026年将该疗法提交美国食品药品监督管理局(FDA)审批。
关于Intellia Therapeutics
Intellia Therapeutics是一家领先的临床阶段基因组编辑公司,正在利用基于CRISPR的技术开发新的、具有潜在治愈作用的疗法。为了充分实现基于CRISPR的技术的变革潜力,Intellia正在寻求两种主要方法。该公司的体内项目使用静脉注射CRISPR作为疗法,其中专有的递送技术能够直接在特定靶组织内对致病基因进行高度精确的编辑。Intellia的离体项目使用CRISPR通过使用工程人类细胞来治疗癌症和自身免疫性疾病,从而创造疗法。Intellia深厚的科学、技术和临床开发经验,以及其强大的知识产权组合,使该公司能够在利用基因组编辑的全部潜力创造新的基因医学类别方面发挥领导作用。

Intellia管线
E.N.D

往期文章推荐:
广东发布新政,支持基因治疗、细胞治疗等创新生物制品研发,重点发展基因技术、细胞治疗、合成生物学等新领域新赛道
Nature官网头条!中国学者发表国际首个通用CAR-T治疗成果
复星医药将在上海打造国内乃至全球最强大、最全面的细胞治疗管线,持续加强肿瘤创新药研发
卫健委:医疗卫生机构开展IIT研究管理办法10月1日起施行(附解读)
总投资5亿元,建筑面积8.8万平米!卡森细胞集团·黄河国际生命科学产业园开工
提高AAV产率新策略,增强ER蛋白加工基因表达可使AAV产量提高100%
40亿元,主要投向细胞基因治疗、医疗器械等领域,江苏无锡成立生物医药产业专项母基金
CXO迎来利好,工信部发文,药品方向重点围绕细胞和基因治疗、多肽药物、新型抗体药物等创新领域加快布局
国家三部门联合发文:四个自贸区允许外资企业从事人体干细胞、基因诊断与治疗技术开发和技术应用!




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论