
2024年9月26日,第27届全国临床肿瘤学大会暨2024年中国临床肿瘤学会(CSCO)学术年会在厦门盛大召开中,北京大学肿瘤医院郭军教授口头报告了特瑞普利单抗对比达卡巴嗪一线治疗晚期黑色素瘤的III期MELATORCH研究详细结果,吸引众多学者关注和讨论。
MELATORCH研究是国内首个达成阳性结果的PD-(L)1抑制剂一线治疗晚期黑色素瘤的关键III期注册临床研究。研究由北京大学肿瘤医院郭军教授担任主要研究者,在全国11家临床中心开展。2024年8月,基于MELATORCH研究结果,国家药品监督管理局(NMPA)正式受理了特瑞普利单抗用于不可切除或转移性黑色素瘤一线治疗的新适应症上市申请。本届CSCO大会首发公布的研究详细数据显示:
研究达到主要终点,与达卡巴嗪相比,特瑞普利单抗治疗显著延长患者无进展生存期(PFS),盲态独立中心阅片(BICR)评估的中位PFS 分别为2.3 vs. 2.1个月,疾病进展或死亡风险降低29.2%(HR=0.708;95% CI: 0.526-0.954),P=0.0209。研究者评估的PFS也显示出一致的获益,中位PFS分别为2.4 vs. 2.1个月,HR=0.673(95% CI 0.508-0.891)。
无论基于BICR还是研究者的评估结果,特瑞普利单抗组的客观缓解率(ORR)均高于达卡巴嗪组,且缓解持续时间(DOR)较达卡巴嗪组显示出明显的延长趋势。
与达卡巴嗪相比,特瑞普利单抗治疗组显示出明显的生存获益趋势。61.2%的达卡巴嗪组患者接受了特瑞普利单抗交叉治疗,两阶段法矫正交叉治疗后结果显示特瑞普利单抗组的总生存期(OS)较达卡巴嗪组明显获益,中位OS分别为15.1 vs. 9.4个月,HR=0.680 (95%CI:0.486-0.951)。
特瑞普利单抗的安全性良好,与既往研究一致,未发现新的安全信号。

郭军教授在2024CSCO大会上报告MELATORCH研究结果
黑色素瘤是恶性程度最高的皮肤癌类型,2022年我国新发黑色素瘤病例8789例,占全球病例的2.7%,但死亡病例达到5385例,占全球病例的9.2%1。近年来,免疫检查点抑制剂在黑色素瘤治疗上已取得巨大成功,是目前国际上晚期黑色素瘤一线标准治疗方案,但目前我国晚期黑色素瘤一线免疫治疗药物有限,临床需求迫切。
2018年我国自主研发的抗PD-1单抗特瑞普利单抗获得NMPA批准用于既往全身系统性治疗失败的晚期黑色素瘤患者的治疗,改变了国内晚期黑色素瘤治疗格局,为众多中国患者带来了突破性的生存获益。为进一步评估特瑞普利单抗一线治疗我国晚期黑色素瘤的有效性和安全性,研究者开展了这项国内多中心注册III期临床研究。
MELATORCH研究(NCT03430297)是一项多中心、随机、开放、阳性药对照的Ⅲ期临床研究,纳入既往未接受过任何系统治疗的不可切除或转移性黑色素瘤患者,以1:1的比例随机接受特瑞普利单抗(240 mg,iv,Q2W)或达卡巴嗪(1000 mg/m2,iv,Q3W)治疗,直至疾病进展或出现不可耐受的毒性。达卡巴嗪组患者在研究者(INV)评估影像学进展后可交叉接受特瑞普利单抗治疗。主要终点为BICR评估的PFS(BICR-PFS)(根据RECIST v1.1标准);次要终点包括研究者评估的PFS(INV-PFS)、ORR、DOR、OS和安全性等。
自2018年2月至2023年4月,研究共有255例患者入组并进入全分析集(特瑞普利单抗组127例,达卡巴嗪组128例)。中位年龄为58.0岁,男性占比55.7%,62.7%的患者为肢端型黑色素瘤,89.4%的患者为BRAF野生型。两组患者基线特征均衡。
研究达到主要终点,特瑞普利单抗一线治疗黑色素瘤,全人群BICR-PFS显著获益
截至2023年7月12日,中位随访时间为11.8个月。相较达卡巴嗪,特瑞普利单抗治疗显著延长BICR-PFS(中位PFS分别为2.3 vs. 2.1个月;P=0.0209),疾病进展或死亡风险降低29.2%(HR=0.708,95%CI:0.526-0.954)(图1)。次要终点INV-PFS也显示出一致的获益,中位PFS分别为2.4 vs. 2.1个月,HR=0.673(95% CI 0.508-0.891)(图2)。

图1. BICR-PFS分析
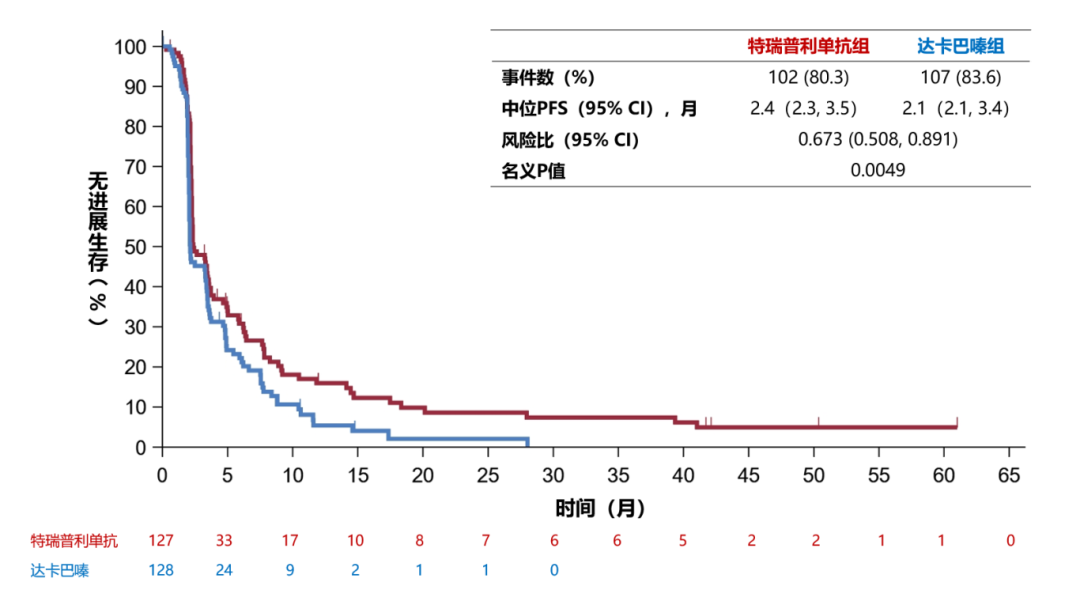
图2. INV-PFS分析
BICR-PFS亚组分析显示,除年龄外所有亚组(包括性别、基线ECOG 状态、M分期和黑色素瘤亚型等)中均观察到特瑞普利单抗组的PFS获益。
特瑞普利单抗一线治疗黑色素瘤,明显提高ORR
无论基于BICR还是研究者的评估结果,特瑞普利单抗组的ORR和DOR较达卡巴嗪组也均显示出获益。两组BICR和研究者评估的ORR分别为11.0% vs. 8.6%、12.6% vs. 9.4%;BICR和研究者评估的中位DOR分别为13.8 vs. 6.9个月、16.1 vs. 8.0个月(表1)。

表1. 其他次要有效性终点
特瑞普利单抗一线治疗黑色素瘤具有明显的OS获益趋势
两组间的后续抗肿瘤治疗存在明显不均衡性(达卡巴嗪治疗组81.3%的患者接受了后续抗肿瘤药物治疗,而特瑞普利单抗组仅55.1%),矫正后续抗肿瘤治疗影响的OS敏感性分析结果显示,特瑞普利单抗组较达卡巴嗪组具有明显的OS获益趋势。针对61.2%的达卡巴嗪组患者接受了特瑞普利单抗交叉治疗,两阶段法矫正交叉治疗后结果显示特瑞普利单抗组的OS较达卡巴嗪组明显获益(中位OS分别为15.1 vs. 9.4个月;HR= 0.680);矫正后续抗肿瘤治疗影响的逆概率删失加权法分析结果同样显示特瑞普利单抗组的OS明显获益趋势(图3)。
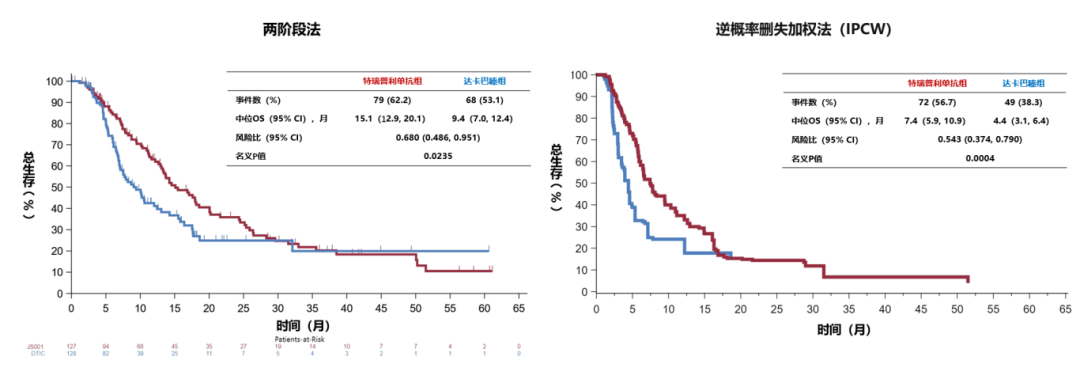
图3. OS敏感性分析
特瑞普利单抗安全性良好,未发现新的安全信号
安全性方面,特瑞普利单抗安全性良好,安全性特征与既往特瑞普利单抗研究一致,未发现新的安全信号。特瑞普利单抗组和达卡巴嗪组治疗相关不良事件(TRAE)发生率分别为92.1% vs. 95.2%,两组≥3级TRAE发生率分别为28.3% vs. 10.3%,两组常见的TRAE(发生率≥15%)如图4所示。
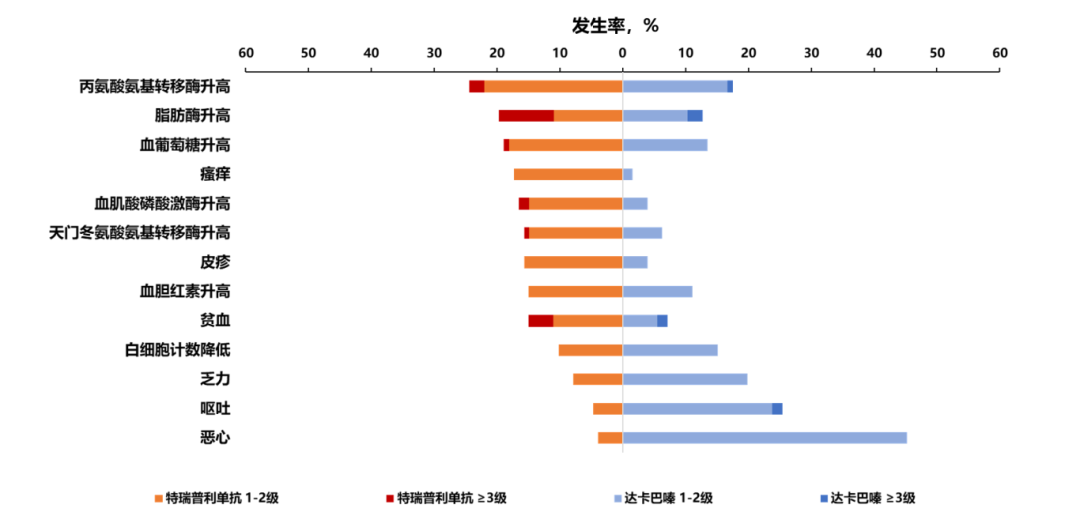
图4. 常见TRAE发生率(任一治疗组发生率≥15%)
特瑞普利单抗一线治疗晚期黑色素瘤患者,相较于达卡巴嗪,显著延长PFS,降低疾病进展或死亡风险29.2%,且安全性良好。作为首个针对中国晚期黑色素瘤患者一线治疗的注册III期研究,本研究结果支持特瑞普利单抗作为晚期黑色素瘤一线治疗的新方案。
参考文献:
https://gco.iarc.who.int/media/globocan/factsheets/populations/160-china-fact-sheet.pdf


声明
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论