
近期召开的2024年欧洲肿瘤内科学会(ESMO)年会上,中国生物制药抗肿瘤创新药的两项研究成功入选“最新重磅摘要(LBA)”,成为业内关注的焦点。其中,1类创新药安罗替尼联合派安普利单抗一线治疗晚期肝细胞癌(HCC)的III期临床研究成果首次亮相,“双终点阳性”的临床数据令人振奋——中位无进展生存期(PFS)为6.9个月,中位总生存期(OS)为16.5个月,PFS和OS均达到预设终点。这是全球第2个口服抗血管生成多靶点小分子酪氨酸激酶抑制剂联合免疫药物组合用于一线治疗晚期肝细胞癌取得阳性结果的III期研究。


LBA40--盐酸安罗替尼胶囊联合派安普利单抗一线治疗晚期肝细胞癌(HCC)--一项随机对照、开放、III期研究(APOLLO研究)

靶免联合开启治疗新篇章
原发性肝癌是我国最常见的恶性肿瘤之一。根据中国国家癌症中心的数据,其新发病例数居各类癌症的第4位,死亡人数和死亡率仅次于肺癌。肝细胞癌(HCC)是肝癌中最常见的类型,约占原发性肝癌的75%-85%。由于HCC起病隐匿,大多数患者确诊时已为中晚期[1-3]。
近年来,以靶向药物和免疫检查点抑制剂为代表的联合疗法为中晚期HCC治疗打开了新格局。本次大会发布的APOLLO研究(ALTN-AK105-III-02)是全球第2项口服抗血管生成的多靶点小分子酪氨酸激酶抑制剂联合免疫药物组合用于一线治疗晚期HCC取得阳性结果的III期研究,旨在评估安罗替尼(新型多靶点酪氨酸激酶抑制剂)联合派安普利单抗(PD-1抑制剂)一线治疗晚期肝细胞癌的有效性和安全性。
PFS、OS均达到预设终点
APOLLO研究(ALTN-AK105-III-02)共纳入晚期肝癌患者649例,其中40.9%的受试者伴有大血管侵犯、甲胎蛋白(AFP) ≥400 ng/mL的比例达到49.2%[4]。
研究结果显示,试验组中位无进展生存期(PFS)为6.9个月,对照组为2.8个月,疾病进展风险显著降低了47%。试验组中位总生存期(OS)为16.5个月,对照组为13.2个月,死亡风险显著降低了31%[4]。PFS和OS均达到了预设终点。
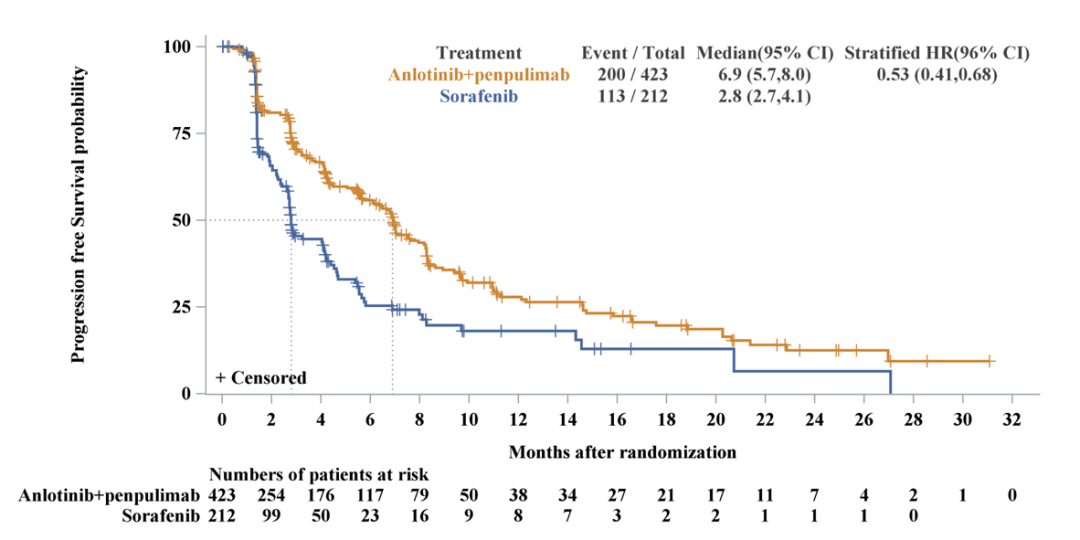
PFS(IRC评估)生存曲线图

OS生存曲线图
安全性分析显示,安罗替尼联合派安普利单抗的安全性数据与已知风险相符,未出现新的安全性信号。安罗替尼联合派安普利单抗的方案有望为晚期HCC患者一线治疗提供新的选择。
新适应症即将申请上市
2024年8月,中国生物制药已与中国国家药品监督管理局药品审评中心(CDE)就安罗替尼联合派安普利单抗一线治疗晚期 HCC 适应症的上市申请进行沟通,并获得 CDE 书面同意。
作为中国生物制药的明星产品——安罗替尼自2018年上市以来已获批6大适应症,另外两项新适应症已递交上市申请,包括二三线治疗子宫内膜癌、一线治疗肾细胞癌。同时,中国生物制药还在推进安罗替尼用于一线非小细胞肺癌、一线结直肠癌、非小细胞肺癌放化疗后维持等新适应症的III期临床。未来,中国生物制药将持续聚焦肿瘤、肝病、呼吸、外科/镇痛四大领域,以临床未被满足的需求为导向,加速新药研发进程,为全球医疗事业的发展贡献力量。
参考文献:
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024 May-Jun;74(3):229-263.
[2] Han B, Zheng R, Zeng H, et al. Cancer incidence and mortality in China, 2022[J]. Journal of the National Cancer Center, 2024, 4(1): 47-53.
[3] 原发性肝癌诊疗指南(2024年版).
[4]Jian Z, et al. Primary results from the phase III ALTN-AK105-III-02 study: Anlotinib plus penpulimab versus sorafenib as first-line (1L) therapy for advanced hepatocellular carcinoma (aHCC). 2024 ESMO, LBA 40.
声明:
1.本新闻稿旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参阅,非广告用途。
2.本公司不对任何药品和/或适应症作推荐。
3. 本新闻稿中涉及的信息仅供参考,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。若您想了解具体疾病诊疗信息,请遵从医生或其他医疗卫生专业人士的意见或指导。
前瞻性声明:
本新闻稿中包含若干前瞻性陈述,包括有关【盐酸安罗替尼胶囊、派安普利单抗注射液】的临床开发计划、临床获益与优势的预期、商业化展望、患者临床获益可能性,以及潜在商业机会等声明。“预期”、“相信”、“继续”、“可能”、“估计”、“期望”、“有望”、“打算”、“计划”、“潜在”、“预测”、“预计”、“应该”、“将”、“拟”、“会”和类似表达旨在识别前瞻性陈述,但并非所有前瞻性陈述都包含这些识别词。这些前瞻性陈述为公司基于当前所掌握的数据和信息所做的预测或期望,可能因受到政策、研发、市场及监管等不确定因素或风险的影响,而导致实际结果与前瞻性陈述有重大差异。请现有或潜在的投资者审慎考虑可能存在的风险,并不可完全依赖本新闻稿中的前瞻性陈述,该等陈述包含信息仅及于本新闻稿发布当日。除非法律要求,本公司无义务因新信息、未来事件或其他情况而对本新闻稿中任何前瞻性陈述进行更新或修改。
内容来源:中国生物制药有限公司于香港联交所发布的公告、中国生物制药有限公司官网、正大天晴药业集团公众号

首登顶级学术盛会+新剂型获批临床 中国生物制药呼吸领域1类新药PDE3/4抑制剂喜讯连连
中国生物制药位列“中国医药创新企业100强”前三强
客观缓解率81.08% 中位PFS达17.25个月 中国生物制药1类新药安奈克替尼ROS1阳性肺癌II期数据刷新
中位总生存期达28.9个月!中国生物制药去化疗联合疗法为EGFR-TKIs耐药肺癌患者点亮新希望
行业排名再进位!中国医药工业百强榜权威发布,中国生物制药旗下双星闪耀










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论